
题目列表(包括答案和解析)


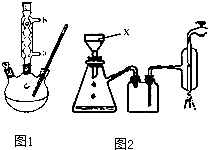 【实验化学】
【实验化学】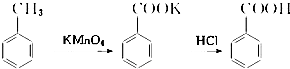
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
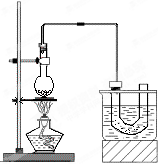 、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)| △ |
| △ |
| 醇 |
| △ |
| 醇 |
| △ |
| 醇 |
| △ |
| 醇 |
| △ |
1.B 2.D 3.C 4.C 5.D 6.B 7.AD 8.BC 9.CD 10.D 11.A 12.C 13.BC 14.C
15.C 16.B 17.B 18.D
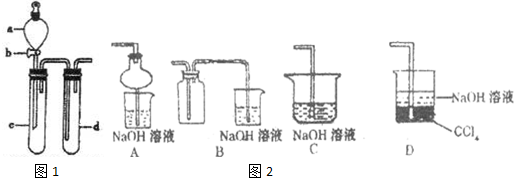
19.(1)②③⑤ (2)①②③④⑥ (3)①②⑦ (4)在A中加满水,盖紧瓶塞,用胶管连接b和c接口,收a导入NO气体,水通过b和c导入B中。
20.(1)甲同学的结论不正确。SO2有还原性,产物有可能是Na2SO4,同时SO2中有水蒸气,也会与Na2O2反应产生O2。(2)①除水蒸气干燥SO2;吸收未反应的SO2。②不合理。稀HNO3能将BaSO3氧化为BaSO4;如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根。
21.(1)S、H2S、SO2、SO3、H2SO4 (2)N2、NH3、NO、NO2、HNO3
(3)3Cu+8H++2NO3― 3Cu2++2NO↑+4H2O
22.(1)(NH4)2SO3(或NH4HSO3); (NH4)2SO4(或NH4HSO4); SO2; NH3; K2SO3; K2SO4
(2)SO32―+Br2+H2O SO42―+2Br―+2H+
23.(1)金刚石、石英、玻璃 (2)SiO2+2NaOH Na2SiO2+H2O
Na2CO3+SiO2 Na2SiO3+CO2↑ CaCO3+SiO2 CaSiO3+CO2↑
24.(1)共价键 NH3 三角锥形 (2)3NO2+H2O=2HNO3+NO
(3)N2(g)+H2(g) NH3(g);△H=-46.2kJ?mol―1 (4)8NH3+Cl2=N2+6NH4Cl
25.(1)N2O,NO2,NO;1: 3: 5 (2)1.08mol
26.(1)①>2;4b;a-2b;H2S(Na2S过量) ②=2;2a(或4b);O;无(正好反应)
③<2;;SO2(Na2S2O3过量) (2)a=3b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com