
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||




| 结构简式 | HOOH-COOH | |||
| 溶解性 | 能溶于水,易溶于乙醇 | |||
| 特性 | 大约在157℃升华(175℃以上发生分解) | |||
| 化学性质 | H2C2O4+Ca(OH)2═CaC2O4↓+2H2O | |||
HOOC-COOH
| ||||
| 2KMnO4+5H2C2O4+3H2SO4═KSO4+2MnSO4+10CO2↑2O |
| 仪器 | A | B | C |
| 加入试剂 | NaOH溶液 |
| 滴定前均为 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管液面刻度 | 0.00mL | 20.02mL | 21.00mL | 19.98mL |
(08福建省实验中学质检)
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:

某兴趣小组欲测定上述反应所制得的样品中碳酸氢钠的纯度,设计了如下两种方案:
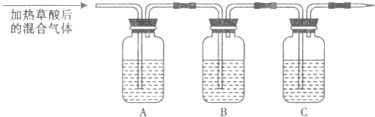
(1)方案一:称取一定质量样品按下图装置(气密性完好)进行实验。

①装置B的作用是_________________________________________________
②装置D的作用是_________________________________________________
③实验中需要称量的装置是______________ (填写字母)
(2)方案二:取w g样品溶于水后,进行下图所示实验:

①试剂X是__________;
②步骤②加入![]() 溶液后的主要操作包括__________、洗涤、_________、称量
溶液后的主要操作包括__________、洗涤、_________、称量
③样品中碳酸氢钠的纯度为_______________________(用含w、m的代数式表示)。
(3)上述方案一测定的结果偏小,可能的原因是__________________________________
| 实验 编号 |
实验步骤 | 实验现象 |
| ① | 用适量的蒸馏水溶解食盐,并将所得溶液分成2份 | |
| ② | 向第一份溶液中加入KSCN溶液,再加入氯水 | 溶液加入KSCN后无明显变化,加入氯水后变红 |
| ③ | 向第二份溶液中加入稀盐酸酸化,再加入足量KI固体,最后加入淀粉溶液 | 溶液变蓝 |
| 实验编号 | 1 | 2 | 3 |
| Na2S2O3溶液的体积/mL | 14.98 | 15.00 | 15.02 |
第Ⅰ卷(选择题 共42分)
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
答案
C
B
C
B
C
A
B
题号
8
9
10
11
12
13
14
答案
C
A
C
D
B
A
C
第Ⅱ卷(共58分)
二、填空题(本题包括4小题,共48分)
15.(13分)
(1)①增大(1分)
②增大 减小(各1分,共2分)
③E(1分)
④t3~t5(1分)
⑤D B(各1分,共2分)
⑥
(2)2NH3+60H--6e-===N2+6H2O(2分) 碱性(1分)
NH3在酸性介质中易转化为NH4+离子(1分)
16.(12分)
(1)第二周期 第VA族(各0.5分共1分)
(2)NH3+H+===NH4+(或H2O+H+===H3O+)(2分)
(3)Al3++3H2O Al(OH)3+3H+(2分)
Al(OH)3+3H+(2分)
(4)NaOH; NH4NO3(各1分共2分)
(5)2H2-4e-+4OH===4H2O(2分)
(6)①A(1分)
②0.25mol2?L-2(或0.25)(2分)
17.(9分)
(1)①吸收CO2中的水蒸汽(或干燥CO2气体)(1分)
②防止空气中的二氧化碳和水蒸汽进入C中(1分)
③C(1分)
(2)①NaOH溶液(1分)
②过滤(1分) 干燥(1分)
③ (2分)
(2分)
(3)方案一中的CO2气体不能完全被装置C中的碱石灰吸收(1分)
18.(14分)
(1)离子键、共价键(或非极性键)(各0.5分共1分)
0.2NA 或1.024×1023 (1分)
(2)Cl2+2OH-===Cl- + ClO- +H2O(2分)
(3)C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O(2分)
(4)NH4++HCO3-+2OH-△NH3↑+CO32-+2H2O(2分)
(或:NH4++HSO3-+2OH-△NH3↑+SO32-+2H2O,
(或:NH4++HS-+2OH-△NH3↑+S2-+2H2O,其它正确答案亦可)
(5)4HCl+NaAlO2===NaCl+AlCl3+2H2O(2分)
(或:4H2SO4+2NaAlO2===Na2SO4+Al2(SO4)3+4H2O,若H2SO4写成硝酸亦可)
(6)2NH4Cl+Ca(OH)2△CaCl2 +2H2O+2NH3↑(2分)
4NH3(g)+5O2(g)===4NO(g)+6H2O(g);△H=-906.8KJ/mol(2分)
三、选做题(本题分A、B两题,考生只要选其中一题作答。若两题都作答,则以A题得分计入总分。本题共10分)
(1)Na<Al<Si<N 高
(2)高 NaCl为离子晶体而SiCl4为分子晶体
(3)三角锥形
(4)1s22s22p63s23p63d104s1(或[Ar] 3d104s1) [Cu(NH3)4]2+
(5)Cu3 N
(6)AlN 共价键
19B.(各1分共10分)
(I)
(II)(1)加成反应 消去反应
(2)浓硫酸、加热
(3) 

(4) 银氨溶液[或新制Cu(OH)2悬浊液]
银氨溶液[或新制Cu(OH)2悬浊液]
(5)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com