
题目列表(包括答案和解析)
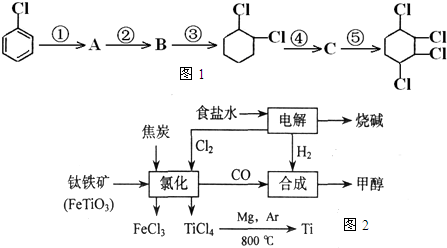
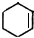

| ||
| ||
| ||
| ||
| ||
| ||
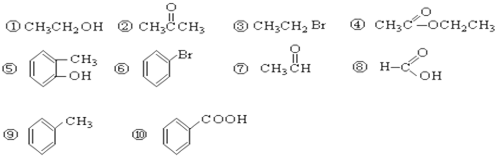
 表示的分子式
表示的分子式 中含有的官能团的名称为
中含有的官能团的名称为
 (Ⅰ)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)
(Ⅰ)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号) (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
| ||
| ||
| ||
| ||
1―5CDBCC 6―10BBABA 11―15CBCDC 16―18ADB
19.(6分)(1)+1(1分) (2)CuI (1分) 0.5(2分)
(3)2、5、2、1(2分)
20.(9分)
|