
题目列表(包括答案和解析)
据下图实验,回答问题:

(1)烧瓶中所发生的主要反应的化学方程式为________,装置(Ⅱ)的烧杯中冷水所起的作用是________;装置(Ⅲ)的烧杯中液体的作用是________.
(2)进行此实验时,烧瓶口的橡皮塞最好用锡箔包好,用橡皮管连接的两玻璃管口要相互紧靠,这是因为________________.
(3)装置(Ⅲ)的烧杯中使用倒置漏斗可防止液体倒吸,试简述原因:________.




 某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0g铝片放入圆底烧瓶中,然后通过分液漏斗加入500mL 0.5mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示),请你帮助该小组同学回答下列问题:
某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0g铝片放入圆底烧瓶中,然后通过分液漏斗加入500mL 0.5mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示),请你帮助该小组同学回答下列问题: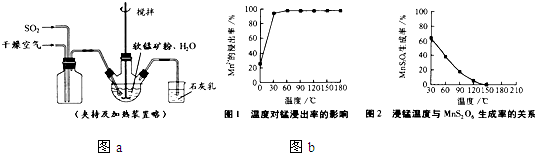
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com