
题目列表(包括答案和解析)
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如下装置(图1),请回答下列问题:
(1)写出Na与H2O反应的化学方程式_____________________________________。
(2)在点燃H2前必须先进行_____________________________________________,
方法是 _______________________________________________________。
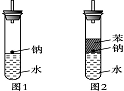 (3)实验小组在点燃用图1装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是________________________________________________________________________。
(3)实验小组在点燃用图1装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是________________________________________________________________________。
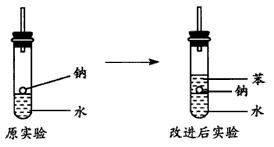
(4)实验小组查阅钠、苯、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进(如图2),在改进后的实验中H2的生成速率减慢。原因是________________________________________________________________________。
(6分)
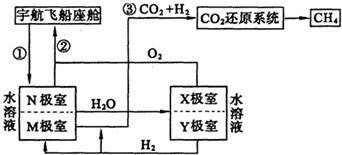
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
请填空:
(1)写出二甲醚完全燃烧生成二氧化碳和水的化学反应方程式:
__________________________________________________________________。
(2)写出用CO和H2合成甲醇的化学方程式:___________________________________。
(3)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
将1.0 molCH4和2.0 molH2O通人反应室1(容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率v(CH4)=_______________________。
温度为T时,向2.0L恒容密闭容器中充入1.0
molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
|
t/s |
0 |
50 |
150 |
250 |
350 |
|
n(PCl3)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
以下对反应过程的分析和判断正确的是
A. 反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1
B.保持其他条件不变,若升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应为放热反应
C. 相同温度下,若起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,则达平衡前v(正)>v(逆)
D.相同温度下,若起始时向容器中充入2.0molPCl3、2.0molCl2,则达平衡时,PCl3的转化率大于80%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com