
题目列表(包括答案和解析)
(11分)实验室用下列方法测定某水样中O2的含量。
(1)用如右图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
实验步骤:
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 。
②用注射器抽取20.00 mL 某水样从A 处注入锥形瓶。
③再分别从A 处注入含m mol NaOH的溶液及过量的MnSO4 溶液。
④关闭止水夹a、b,将锥形瓶中溶液充分振荡;
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:
MnO(OH)2+2I-+4H+==Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A 处注入足量NaI溶液及含n mol H2SO4硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应方程式为:I2+2Na2S2O3==2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴 作指示剂。
⑧用0.005 mol · L-1Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如右图所示。
⑨经计算,此水样中氧(O2)的含量为(单位:mg·L-1) 。
⑩本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定量的关系,即应加适量的H2SO4使溶液呈 (填“酸性”、“碱性”或“接近中性”),其原因是 。
实验室用下列方法测定某水样中O2的含量。

(1)用如图所示装置,使水中溶解的O2在碱性条件下将Mn2+氧化成MnO(OH)2的反应的离子方程式为______________________________________。
实验步骤:
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是______________________________________。
②用注射器抽取20.00 mL某水样从A处注入锥形瓶。
③再分别从A处注入含m mol NaOH的溶液及过量的MnSO4溶液。
④完成上述操作后,下面应进行的操作是_______________。c是长橡胶管,使用较长橡胶管的目的是__________________________________。
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂。
⑧用0.005 mol·L-1的Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如图所示。
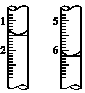
⑨经计算,此水样中氧(O2)的含量为________mg·L-1。
实验室用下列方法测定某水样中O2的含量。
(1)用如图所示装置,使水中溶解的O2在碱性条件下将Mn2+氧化成MnO(OH)2的反应的离子方程式为______________________________________。
实验步骤:
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是______________________________________。
②用注射器抽取20.00 mL某水样从A处注入锥形瓶。
③再分别从A处注入含m mol NaOH的溶液及过量的MnSO4溶液。
④完成上述操作后,下面应进行的操作是_______________。c是长橡胶管,使用较长橡胶管的目的是__________________________________。
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂。
⑧用0.005 mol·L-1的Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如图所示。
⑨经计算,此水样中氧(O2)的含量为________mg·L-1。
(13分)实验室用下列方法测定某水样中O2的含量。
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
① 打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 ;
② 用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③ 再分别从A 处注入含m mol NaOH溶液及过量的MnSO4溶液;
④ 完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤ 打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥ 重复④ 的操作。
⑦ 取下锥形瓶,向其中加入2~3滴 作指示剂;
⑧ 用0.005 mol · L—1Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为 (单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将 (填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是 。
实验室用下列方法测定某水样中O2的含量。

(1)用如图所示装置,使水中溶解的O2在碱性条件下将Mn2+氧化成MnO(OH)2的反应的离子方程式为______________________________________。
实验步骤:
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是______________________________________。
②用注射器抽取20.00 mL某水样从A处注入锥形瓶。
③再分别从A处注入含m mol NaOH的溶液及过量的MnSO4溶液。
④完成上述操作后,下面应进行的操作是_______________。c是长橡胶管,使用较长橡胶管的目的是__________________________________。
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂。
⑧用0.005 mol·L-1的Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如图所示。

⑨经计算,此水样中氧(O2)的含量为________mg·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com