
题目列表(包括答案和解析)
(12分)(2011·银川高二检测)化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列ΔH表示物质燃烧热的是________;表示物质中和热的是________。(填ΔH1、ΔH2和ΔH3等)
A.2H2(g)+O2(g)===2H2O(l) ΔH1
B.C(s)+O2(g)===CO(g) ΔH2
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)===CO2(g) ΔH4
E.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH7
(2)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P—P |
P—O |
O===O |
P===O |
|
键能kJ/mol |
197 |
360 |
499 |
x |
已知白磷(P4)的燃烧热为2 378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=________。


| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | C-C | C-H | H-H | S-H | S-S | S-C |
| 键能/kJ.mol-1 | a | b | c | d | e | f |
下列热化学方程式书写正确的是( )
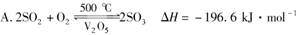
B.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
已知:体系的自由能变化ΔG=ΔH-TΔS<0时,反应能自发进行。下列反应中,一定不能自发进行的是( )
| A.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS="1110" J/(mol·K) |
| B.CO(g)=C(s,石墨)+1/2O2(g) ΔH=110.5kJ/mol ΔS="-89.36" J/(mol·K) |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3kJ/molΔS="-280.1" J/(mol·K) |
| D.NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l) |
下列热化学方程式书写正确的是( )
A.2SO2+O2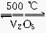 2SO3 ΔH=-196.6
kJ·mol-1
2SO3 ΔH=-196.6
kJ·mol-1
B.H2(g)+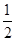 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ·mol-1
D.C(s)+O2(g)===CO2(g) ΔH=393.5 kJ·mol-1
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
11
答案
D
C
B
C
D
C
D
B
B
C
D
题号
12
13
14
15
16
17
18
19
20
21
答案
B
C
D
CD
D
ABD
C
BC
ACD
BC
.files/image097.jpg) 22Ⅰ桌面离地面高度h (2分)
22Ⅰ桌面离地面高度h (2分).files/image099.gif) (4分)
(4分)
Ⅱ.(1)图乙 (2分) D、E (2分) 大于(2分)
(2)6分
23、解:⑴甲车运动时间ts后停止 .files/image101.gif) (2分)
(2分)
前进了S甲m .files/image103.gif) (3分)
(3分)
乙车行驶t1=0.5s位移为 .files/image105.gif)
故乙车在追上甲车前甲车已停止。(3分)
则乙车经时间t2追上甲车.files/image107.gif) (3分)
(3分) .files/image109.gif) (3分
(3分
24、解:(1)金属棒cd从静止开始运动直至细绳刚好被拉断的过程中有:
Qab =U2t/Rab ① (1分) QR=U2t/R ② (1分)
联立①②可得Qab=0.4J ③ (1分)
Qcd =I2Rcdt ④ (1分) Qab + QR =I2RRabt/(Rab+R) ⑤(1分)
联立④⑤可得Qab =0.9J ⑥ (1分)
(2) 细绳被拉断瞬时,对ab棒有:
Fm=mg+BIabL ⑦ (2分)
又有IR=RabIab/R ⑧ ( 1分) Icd=Iab+Icd ⑨ (1分)
又由闭合欧姆定可得 BLv=Icd [Rcd+RabR/(Rab+R)] ⑩ (2分)
联立⑦⑧⑨⑩可得v=
(3)由功能关系得 Mgh= Q总 +mv2/2 ?(4分)
即可得h=
25、解:(1)以小球为研究对象,竖直方向小球受重力和恒定的洛伦兹力f1,故小球在管中竖直方向做匀加速直线运动,加速度设为a,则.files/image111.gif) (5分)
(5分)
(2)在小球运动到管口时,FN=2.4×10-3N,设v1为小球竖直分速度,
由.files/image113.gif) ,则
,则.files/image115.gif) (4分)
(4分)
由.files/image117.gif) 得
得.files/image119.gif) (4分)
(4分)
(3)小球离开管口进入复合场,其中qE=2×10-3N,mg=2×10-3N. (1分)
故电场力与重力平衡,小球在复合场中做匀速圆周运动,合速度.files/image121.gif) 与MN成45°角,轨道半径为R,
与MN成45°角,轨道半径为R,.files/image123.gif) (2分)
(2分)
小球离开管口开始计时,到再次经过MN所通过的水平距离.files/image125.gif) (2分)
(2分)
.files/image127.jpg) 对应时间
对应时间.files/image129.gif) (2分)
(2分)
小车运动距离为x2,.files/image131.gif) (2分)
(2分)
则Δx=2―.files/image133.gif) (m)
(m)
26.答案:(1).files/image135.gif) 或
或.files/image137.gif) 或
或.files/image139.gif) (用
(用.files/image141.gif) 代替NO也可)
代替NO也可)
[说明:答案合理均给分,不写条件扣1分,不配平扣1分,化学式写错不得分(下同)]
(2)(每空2分)A:.files/image143.gif) B:
B:.files/image145.gif) 2∶1
2∶1
(3)(每空2分).files/image147.jpg) 三角锥形
三角锥形 .files/image149.gif)
(4)(每空2分)①4OH-- 4e-= O2 + 2H2O ②③ 省略
27.(1)(每空2分)
.files/image151.jpg) 取代反应(酯化反应) 氧化反应
取代反应(酯化反应) 氧化反应
(2)①.files/image153.jpg)
②.files/image155.jpg)
(3)9种
(4)由于高分子中支链大,高分子之间间距就大,所以有良好的透气性,分子中有许多羟基,所以有良好的亲水性.
28.(1)B、D、F
选择B,目的:除去空气中的水蒸气
选择D,目的:除去空气中的CO2
选择F,目的:除去空气中的O2
(2)h→g→d→c→k→l→a→b
(3)将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
29.(1)过量、不足。
(2)要推导盐酸的物质的量浓度,应知道盐酸的体积和HCl的物质的量。现已知盐酸的体积,HCl的物质的量可以通过乙或丙组实验产生H2的物质的量进行计算。
则:所提供的数据为:300mL(盐酸的体积)和3360mL(H2的体积)。
cmol/L×
(3)甲组实验中,镁、铝合金完全参加反应,依据合金的质量(
设:合金中镁、铝的物质的量分别为x、y。
.files/image156.gif)
则:镁、铝的物质的量之比为1∶1。
(4)在丙实验之后,向容器中加入一定体积的苛性钠溶液,恰好使铝元素全部以偏铝酸根形式存在,使镁离子刚好沉淀完全,此时溶液中的溶质为NaAlO2和NaCl。
则n(NaAlO2)=n(Al)=
n(NaCl)=n(HCl)=1mol/L×
n(NaOH)=n(NaAlO2)+n(NaCl)=0.09 mol+0.3 mol=0.39 mol
V(NaOH)=0.39
mol÷1mol/L=
30、(24分)(1)ABCE (1分)
(2)①通过根吸收,由根茎叶导管运至叶,通过叶的蒸腾作用散失于空气中。(2分)
②在光合作用的光反应中,叶绿体色素吸收光能,将水分解为O2,散失于空气中 (2分)
③光合作用 有氧呼吸 蛋白质的生物合成 (2分)
④C6H12O6、氨基酸、脂肪等 (1分)
(3)(4分)抗利尿激素 肾小管细胞 失水的同时也大量失盐,细胞外液渗透压没有升高,下丘脑和大脑皮层没有明显反应。
(4)(4分)①在一定范围内随着含水量的增加,呼吸速率增加
②12%
③通过有氧呼吸产生水,使粮仓湿度加大而发潮,有氧呼吸产生的能量一部分变为热能,使粮仓发热。
④将种子晒干,并贮藏在干燥地方 降低贮藏种子的温度
(5)(8分)①A.(15+5+55)-(65×0.55+35×1.05)=2.5g
B.(30+15+75)-(65×0.55+35×1.05)=47.5g
②脱水或实验条件下水分供给不足
③物种A运动减少、出汗减少,散热减少,有利节水
④A、B通过尿液排出的尿素的相对量分别为:3500×15和2000×30 由于B排出的尿素量多,故B可能为肉食动物
31、(18分)
①如四组大鼠肝癌发生率相同,(或都不发生肝癌)说明苏丹红Ⅳ号不会诱发大鼠肝癌。(2分)
②如肝癌发生率为丙>乙>甲>丁,说明苏丹红Ⅳ号会诱发大鼠肝癌,剂量越大癌变率越大. (2分)
③如甲乙丙大鼠肝癌发生率相近,都高于丁,说明苏丹红Ⅳ号会诱发大鼠肝癌,但跟剂量大小无关。(2分)
癌变细胞 (1分) (1)细胞能无限制的分裂。(2)细胞的形态发生改变。(3)细胞膜外的糖蛋白(糖被)减少。 (3分)
(1)形态变异的细胞数目占全部培养细胞的百分数 (2分)
(2)第二步,向1号培养瓶中加入适量水,向2~6号培养瓶中加入等量不同浓度的苏丹红添加剂;(2分)
笫三步,配制动物细胞培养液(或培养基)将上述各组细胞进行恒温培养一段时间, (2分)
结论:低浓度的苏丹红毒性很小,100 mg?Lˉ1以上毒性明显(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com