
题目列表(包括答案和解析)
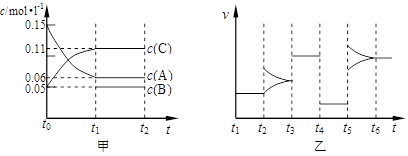
向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c( B)未画出,t1时增大到0.05mol/L]。乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。

(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为 mol/L;
该反应的平衡常数表达式为K= 。
(2)若t5时改变的条件是升温,此时v(正) > v(逆),平衡常数K的值将 (选填“增大”、“减小”或“不变”)。
(3)若 t1= 15s,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=
mol/L·s。t3 时改变的某一反应条件可能是 (选填序号)。
a.使用催化剂 b.增大压强 c.增大反应物浓度 d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式 。
向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c( B)未画出,t1时增大到0.05mol/L]。乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为 mol/L;
该反应的平衡常数表达式为K= 。
(2)若t5时改变的条件是升温,此时v(正) > v(逆),平衡常数K的值将 (选填“增大”、“减小”或“不变”)。
(3)若 t1= 15s,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=
mol/L·s。t3时改变的某一反应条件可能是 (选填序号)。
a.使用催化剂 b.增大压强 c.增大反应物浓度 d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式 。

 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol| 2c |
| 3 |
| c |
| 3 |
| 2c |
| 3 |
| c |
| 3 |

| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
题号
1
2
3
4
5
6
7
8
9
10
答案
B
D
B
B
C
C
B
C
D
B
题号
11
12
13
14
15
16
17
18
19
20
答案
B
D
C
B
C
D
D
B
C
B
25. 答案.(1)甲:能(1分);乙:不能(1分);丙:不能(1分)
乙方案:混合气体在通过B时,因发生反应:NO+NO2+2NaOH 2NaNO2+H2O使NO消耗,后续实验无法验证是否有NO(3分)。
2NaNO2+H2O使NO消耗,后续实验无法验证是否有NO(3分)。
丙方案:混合气体通过F时,NO2与H2O蒸气发生反应:3NO2+H2O 2HNO3+NO
使部分NO2转化为NO,产生干扰,从而不能确认Cu和浓HNO3反应是否有NO生成(3分)。
2HNO3+NO
使部分NO2转化为NO,产生干扰,从而不能确认Cu和浓HNO3反应是否有NO生成(3分)。
(2)排尽整个装置中的空气,防止产生的NO被氧化生成NO2(2分)
(3)D装置中通入O2后有红棕色气体产生(2分)
(4)4NO2+O2+4OH- 4NO3-+2H2O(2分)
4NO3-+2H2O(2分)
26. (每空2分,本题共12分)(1)蒸发结晶(或蒸发)
(2)①NH3 ②增加NH4+的浓度,有利于沉淀平衡向生成NH4Cl的方向进行,将NaHCO3转化为Na2CO3而不析出。
 (3)①用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。 (答焰色反应也给分)
(3)①用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。 (答焰色反应也给分)
②HCl(气流) MgCl2?6H2OMg(OH)Cl+HCl+5H2O
27.
(1)0.200 mol(不带单位不给分)
(2)Cl2+2OH-=Cl-+ClO-+H2O(4分)
(3)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
(4)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O(或:NH4++HSO3-+2OH-
NH3↑+CO32-+2H2O(或:NH4++HSO3-+2OH- NH3↑+SO32-+2H2O,或:NH4++HS-+2OH-
NH3↑+SO32-+2H2O,或:NH4++HS-+2OH- NH3↑+S2-+2H2O,其它正确答案亦可)(6分)
NH3↑+S2-+2H2O,其它正确答案亦可)(6分)
(5)4HCl+NaAlO2=NaCl+AlCl3+2H2O(或:4H2SO4+2NaAlO2=Na2SO4+Al2(SO4)3+4H2O,注:若H2SO4写成硝酸亦可)(3分)


 28. (1)CH3
CH COOH CH
28. (1)CH3
CH COOH CH
CH3 CH3

 (2) CH
(2) CH
CHO


 (3) CH3C(CH 2 CI) CH2 +NaOH CH3(CH2OH)C CH 2 + NaCI
(3) CH3C(CH 2 CI) CH2 +NaOH CH3(CH2OH)C CH 2 + NaCI

 CH 3 CH3
CH 3 CH3






 nCH
nCH
COOCH3
(4) 水解 取代 氧化(3分)

 (5)CH3CH
CHCOOH CH2 CHCH2COOH(3分)
(5)CH3CH
CHCOOH CH2 CHCH2COOH(3分)
其它每空2分
29.(共18分)
Ⅰ.(1)O2(1分)
(2)试管中的液体应用同体积的清水 种子吸收的氧气量与释放的二氧化碳气体量的差值 (4分)
(3)(x―y)/x (2分)
(4)用死种子,试管中放等量的清水 x+z (4分)
(5)①光照强度 NaHCO3 NaHCO3既能为植物光合作用提供二氧化碳,又可以保持瓶中二氧化碳气体量不变,便于实验分析(3分)
②右(1分)
③遮光一定时间,记录呼吸作用墨滴移动刻度 遮光情况下测得的(或呼吸作用)数据加光照情况下测得的数据(共3分)
Ⅱ.(每空2分,共14分)
(1)②将荧光器粉末分成若干等份分别放入试管,贴上标签
③在每支试管中加入等量不同浓度的ATP溶液
④观察发光现象并记录
(2)①发光现象随ATP溶液浓度升高而渐强,说明荧光强度与ATP浓度呈正相关
②发光现象随ATP溶液浓度升高而渐弱,说明荧光强度与ATP浓度呈负相关
④ 在不同浓度ATP溶液的条件下,发光现象没有变化,说明荧光强度与ATP浓度无关
(3)在一定的ATP浓度范围内,荧光强度与ATP浓度呈正相关
30.(每空1分,共14分)(1)体液免疫
(2)糖蛋白 识别
(3)增殖、分化(答不全不给分) 是 由B细胞有丝分裂而来,在分裂过程中染色体经复制后平均分配到子细胞中去
(4)记忆 同一种抗原再次进入机体 浆 抗体
(5)T 效应T 淋巴因子 会
31.(每小题2分,共8分)
(1)草原生态系统的营养结构简单(或营养结构上的生物种类少)
(2)CD (3)既能保持草原生态系统的稳定性,又能获得较高的畜牧产量
(4)草原退化,严重时会导致草场的沙漠化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com