
题目列表(包括答案和解析)
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |

| 元素素素素 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
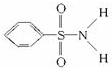 ,其中S-N中,你认为共用电子对偏向
,其中S-N中,你认为共用电子对偏向下面是某些短周期元素的x值:
元素符号 | Li | Be | B | C | O | F |
x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
元素符号 | Na | Al | Si | P | S | Cl |
x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg、N的x值范围:__________<x(Mg)<__________,__________<x(N)<__________。
(2)推测x值与原子半径的关系是__________,短周期元素x值变化特点,体现了元素性质的__________变化规律。
(3)经验规律告诉我们:当成键的两原子相应元素的差值Δx>1.7时,一般为离子键;当Δx<1.7时,一般为共价键。试推断AlBr3中化学键类型是__________。
(4)预测元素周期表中,x值最小的元素位置:____________________(放射性元素除外)。
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
答案
D
A
B
C
D
B
C
B
D
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
题号
10
11
12
13
14
15
16
17
18
答案
AC
AD
AB
C
D
C
AD
B
C
三.(本题包括3小题,,共34分)
19.(14分)
(1)烧杯、玻璃棒,过滤,换过滤器并重新进行过滤操作(4分,每空1分)
(2)NaOH、Na2CO3(2分) (其他合理的试剂也可给分)
(3)NaOH , C (2分,各1分)
(4)除去NaOH和Na2CO3(2分)
(5)蒸发皿,蒸发皿中有大量固体析出(2分,各1分)
(6)加快沉淀生成 , 5.61×10―8 mol?L―1。(2分,各1分) ]
20.(7分)
(1)掩蔽Fe3+,防止造成偏大的误差(1分)
(2)提供酸性条件,抑制Cu2+的水解(1分)
(3)防止空气中的氧气与碘化钾反应(1分)
(4)2Cu2++4I-=2CuI↓+I2 (2分)
(5)ω(Cu)= 64CV/
21.(13分) (1分)
⑴(2分)测定pH 或滴加Na2CO3溶液 或将甲酸滴加到滴有酚酞的NaOH溶液中(不能用Na,其它合理答案均可得分)
⑵(2分)测定HCOONa溶液的pH;或将等pH的HCOOH溶液和HCl溶液稀释相同倍数,测其pH的变化;或比较等浓度甲酸和盐酸的导电性等(合理均可给分)
⑶(2分)出现银镜,由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质(1分。羧基中C原子和2个O原子之间形成1个大л键,而使甲酸分子中的醛基性质不太典型);或答稀氨水量不足,使甲酸与银氨溶液混合后仍显酸性(1分)
⑷ ① 甲酸在浓硫酸的作用下脱水生成CO和H2O(2分)
 ②(4分)
②(4分)
四.(本题包括3小题,共34分)
22.(9分)(每空各1分)
(1)氮气 ,氮化硅(化学式同样给分)
(2)K=[c(CO)]6/[c(N2)]2
(3)< , 减小,6 mol•L-1.min‑1
(4)升高温度或增大压强 , t3∽t4
(5)50% (3分)
23.(11分)
(1)D (1分)
(2)Cu (1分)
(3)H2 (1分) ;①随着反应进行生成铝离子浓度增大,水解程度增大,产生H+的浓度增大;②该反应放热,升高温度反应加快; ③铜与铝构成原电池,加快铝溶解。(3分)
(4)A、B、D (3分)
(5)A(1分),电解质性质(合理解答同样给分) (1分)
24.(12分)
|