
题目列表(包括答案和解析)
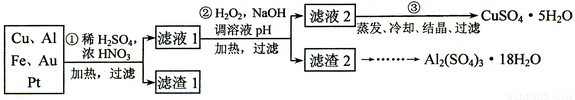
(18分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程为____________________________________;
得到滤渣1的主要成分为___________________。
⑵ 第②步加H2O2的作用是___________________________________________,使用H2O2的优点是________________________;调溶液pH的目的是使__________________生成沉淀。
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_____________________________。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案: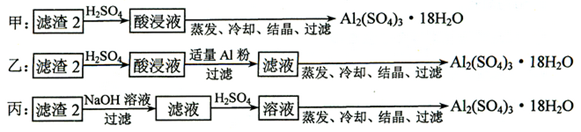
上述三种方案中,_________________方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:
Cu2+ + H2Y2- = CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
⑴第①步Cu与酸反应的离子方程式为 ;得到滤渣1的主要成分为 。
⑵第②步加入H2O2的作用是 ,使用H2O2的优点是 ;调节pH的目的是使 生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
⑷由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
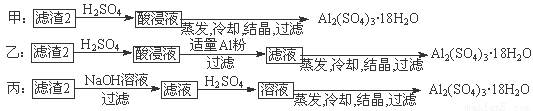
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol/L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-=CuY2-+ 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= ;
下列操作会导致CuSO4·5H2O含量测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除静可与EDTA反应的干扰离子
(18分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程为____________________________________;
得到滤渣1的主要成分为___________________。
⑵ 第②步加H2O2的作用是___________________________________________,使用H2O2的优点是________________________;调溶液pH的目的是使__________________生成沉淀。
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_____________________________。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
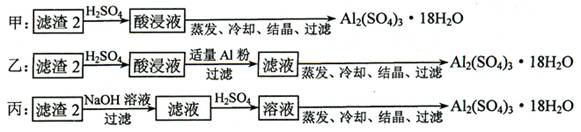
上述三种方案中,_________________方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:
Cu2+ + H2Y2- = CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
回答下列问题:
⑴第①步Cu与酸反应的离子方程式为 ;得到滤渣1的主要成分为 。
⑵第②步加入H2O2的作用是 ,使用H2O2的优点是 ;调节pH的目的是使 生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
⑷由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol/L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-=CuY2-+ 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= ;
下列操作会导致CuSO4·5H2O含量测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除静可与EDTA反应的干扰离子
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程式为___________________________________;
⑵ 第②步加H2O2的作用是把Fe2+氧化为Fe3+,使用H2O2的优点是___________________;
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是____________________________(填仪器名称和操作方法)。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,______方案不可行,从原子利用率角度考虑,_______方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol· L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+
在往滴定管中装入标准液之前,滴定管应该先经过 ,再用水清洗干净,
然后再 ,方可装入标准液。排除酸式滴定管尖嘴处气泡的方法是 。在滴定时, 手操作滴定管活塞。
(6)写出计算CuSO4·5H2O质量分数的表达式(要求带单位)ω= _____________ ;
(7)下列操作会导致CuSO4·5H2O含量的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡 ks5u
c.未除净可与EDTA反应的干扰离子
d.读取滴定管中待测液的初始体积时仰视
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
答案
D
B
A
A
C
D
C
D
B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个,该小题就为0分)
题号
10
11
12
13
14
15
16
17
18
答案
BD
C
B
C
C
CD
D
AD
AB
说明:非选择题的化学方程式、离子方程式中,化学式错、配平错,给0分;“↑”“↓”符号、条件等错漏扣一半分。
三、(本题包括3小题,共34分)
19.(10分)
(1) Cu2++ CO32-+H2O= Cu(OH)2 ↓+CO2↑
或CO32-+H2O HCO3-+OH-,Cu2++2OH‑=
Cu(OH)2 ↓ (2分)
HCO3-+OH-,Cu2++2OH‑=
Cu(OH)2 ↓ (2分)
(2)取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净。(2分)
(3)CuSO4、澄清石灰水 (各1分,共2分)
(4)B中无水硫酸铜变蓝,澄清石灰水不变浑浊(各1分,共2分)
(5) 实验结束后装置中残留的气体不能被吸收;装置中原有的空气有影响;石灰水可能会吸收空气中的CO2。(2分,答任一点即可)
20.(12分)
(1)取少量滤液加入试管中,先滴加KSCN溶液(1分),再滴加氯水(或双氧水、稀硝酸)(1分),溶液由浅绿色变为血红色(1分)。 (共3分,合理即给分)
(2)将Fe2+全部氧化为Fe3+(1分)
(3)Fe3++3OH―=Fe(OH)3↓(或Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+) (2分)
(4)过滤、冷却(各1分,共2分)
(5)①250mL容量瓶 (1分) ②b (1分)
(6) 69.5mg(2分)
21.(12分)
(l)假设2 :溶液中存在SO32―和HCO3―( 1分)
假设3、溶液中存在HCO3―和SO42―(2和3顺序不限。)(1分)
(2)
步骤编号
实验操作
预期现象和结论
①
用胶头滴管取少量溶液加入试管A中,再用滴管取过量的lmol/L氯化钡溶液并滴入其中(1分),充分反应,静置,然后将沉淀和上层清液分别装入另外的两支试管B、C中(1分)
产生白色沉淀,说明原溶液中含有SO42―或SO32―或两者都有(2分)
②
往装有沉淀的试管B中加入过量的2mol/L盐酸,将产生的气体通入品红溶液(1分)
沉淀部分溶解, 并产生气体. (1分)
品红褪色,说明原溶液中一定含有SO42―和SO32―(1分)
③
往装有上层清液的试管C中加入2mol/L盐酸;将产生的气体通入澄清石灰水(1分)
产生无色气泡, (1分)
澄清石灰水变浑浊,说明原溶液中含有HCO3―(1分)
④
其它方案合理给分
四、(本题包括3小题,共34分)
22.(11分)
(1) (2分)
C(NH3)(mol?L-1)
(2分)
C(NH3)(mol?L-1)
 (2)50% (2分)
(2)50% (2分)
(3)a、c (2分,答对1个1分,多选、选错为0分)
(4)向正反应方向(1分);不变(1分)
(5)(3分)如右图:
23.(11分)
(1)BaSO4(s)+4C(s)= BaS(s)+4CO(g);△H=+571.2 kJ•mol-1 (2分)
(2)S2-
+ H2O  HS- + OH-(2分)
HS- + OH-(2分)
(3)解:设每次用1.00L 2.0 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4
BaSO4+CO32-=BaCO3+SO42-
(2.0-x) mol•L-1 x mol•L-1
|