
信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
回答下列问题:
⑴第①步Cu与酸反应的离子方程式为 ;得到滤渣1的主要成分为 。
⑵第②步加入H2O2的作用是 ,使用H2O2的优点是 ;调节pH的目的是使 生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
⑷由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol/L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-=CuY2-+ 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= ;
下列操作会导致CuSO4·5H2O含量测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除静可与EDTA反应的干扰离子
⑴Cu+4H++2NO3- Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O;Au、Pt
3Cu2++2NO↑+4H2O;Au、Pt
⑵把Fe2+氧化为Fe3+;不引入杂质,产物对环境物无污染;Fe3+和Al3+。
⑶在坩埚中加热脱水
⑷甲;甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;乙。
⑸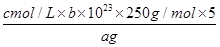 ×100%;c。
×100%;c。
解析试题分析:(1)浓硝酸与稀硝酸混合,硝酸可能为浓溶液,也可能为稀溶液,所以两个离子方程式都可;Au、P他不和硝酸反应,所以滤渣1的主要成分为:Au、Pt。
(2)第②步加H2O2的作用是把Fe2+氧化为Fe3+;H2O2作氧化剂。其还原产物为H2O,所以该氧化剂的优点是不引入杂质,产物对环境物无污染;调溶液PH的目的是使Fe3+和Al3+形成沉淀。
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水。
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行。乙和丙方法均可行。乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体。丙方案先在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3, 蒸发、冷却、结晶、过滤可得硫酸铝晶体。但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费。
(5)根据离子方程式,Cu2+的物质的量等于EDTA的物质的量,所以由EDTA的物质的量可求出CuSO4?5H2O的物质的量,因为配制了100mL CuSO4溶液,每次取20.00mL实验,所以再乘以5,可得样品中CuSO4?5H2O的物质的量,进而求出CuSO4?5H2O的含量;a、未干燥锥形瓶,为正确操作,不影响结构;b、滴定终点时滴定管尖嘴中产生气泡,使标准液的体积测量值变小,结构偏小;c、未除净可与EDTA反应的干扰离子,增加了EDTA的用量,使结果偏高。
考点:本题考查离子方程式的书写、试剂的作用、实验方案的分析、中和滴定的简单计算和误差的分析。


科目:高中化学 来源: 题型:单选题
下列实验操作中正确的是( )
| A.用干燥的pH试纸测定某氯水的pH |
| B.做完银镜反应的试管可以用氨水来洗涤 |
| C.为了除去乙酸乙酯中混有的少量乙酸,加入足量氢氧化钠溶液,充分搅拌后分液 |
| D.如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
熟悉和使用中学化学实验中常见仪器及用途,是化学学习的基本要求。试回答下列问题。
(1)在仪器a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是________(填序号)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有________(填序号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶)
d.集气瓶 e.酸式滴定管 f.碱式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题: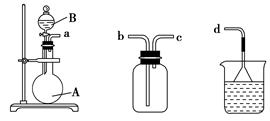
甲 乙 丙
①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为________,制取该气体利用了B的性质有________、________。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为________。
②若在乙中收集氨气,气体流经装置的顺序是:a―→____―→_____―→d(填接口代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学是一门以实验为基础的自然科学,进行化学实验时要熟悉中学化学实验中常见仪器及用品,采取正确的实验操作,注意实验安全。
(1)在仪器:a.分液漏斗、b.试剂瓶、c.集气瓶、d.滴定管、e.容量瓶、f.量筒、g.托盘天平中,标有“0”刻度的是(填序号,下同) ;标有具体使用温度的是 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到“磨砂”工艺处理的有 。
a.试管
b.分液漏斗
c.带滴管的试剂瓶(滴瓶)
d.集气瓶
e.酸式滴定管
f.碱式滴定管
(3)下列操作所得实验结果比实际数值偏高的是( )
a.用量筒量取8.5 mL液体时,俯视液面读数
b.中和滴定达到终点时,仰视液面读数
c.配制一定物质的量浓度的溶液定容时,仰视溶液液面
(4)在盛放浓硫酸的试剂瓶的标签上印有如图所示的警示标志,说明浓硫酸是一种 。
(5)有同学想用下图所示装置以大理石和稀盐酸反应制取CO2,老师指出,这需要太多的稀盐酸,造成浪费,该同学选用了实验室最常用的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室配制500mL 0.1mol/L的NaOH溶液,有如下操作步骤:
①计算所需NaOH固体的质量并用托盘天平称取;
②将称量好的NaOH固体放入烧杯中,加入适量的蒸馏水溶解,然后转移至容量瓶中;
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;
④继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
⑤塞紧容量瓶的塞子,充分摇匀。
回答下列问题:
(1)容量瓶在使用前,必须
(2)实验中用托盘天平实际称取NaOH固体的质量是
(3)上述实验操作②中,缺少的步骤是
(4)在实验中,未进行操作③,所配溶液的浓度会 (填“偏高”、“偏低”或“无影响”,下同);定容时俯视液面,所配溶液的浓度会 。称量前容量瓶有少量水,所配溶液的浓度会 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一。
(1)下列有关叙述正确的是__________(填写序号)
a.使用托盘天平的第一步操作是将游码移至标尺零刻度处
b.过滤操作过程中,为加快过滤速度可用玻璃棒对漏斗中的溶液进行搅拌
c.用浓硫酸配制稀溶液时,在量筒中衡稀后要冷却至室温再转移到容量瓶中
d.用容量瓶配制溶液时,定容后摇匀液面下降,再加蒸馏水至刻度线处,所得溶液浓度偏低
(2)现有六种气体:H2、O2、NH3、SO2、NO2、NO。可以利用如图所示装置进行收集。
①若气体从B口进入,可收集的气体是_______________;
②若在烧瓶中注满水,则气体应该从___(填写“A”或“B”)口进入,可以收集的气体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
利用反应I2(s)+Cl2(g)=2ICl(l),实验室可用如下图所示装置(加热、夹持仪器已略去)制取少量IC1。
已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:
ICl(l)+Cl2(g)=2ICl3(l)
(1)装置A中发生反应的化学方程式是____________。
(2)装置B的作用是______。不能用装置F代替装置E,理由是____________。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现。这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,然后立即转变为普通氧分子,多余的能量以红光放出。本实验所用的仪器及导管如图。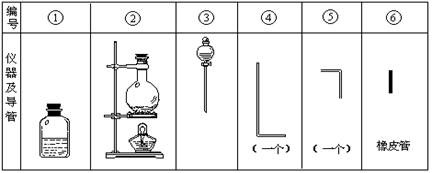
根据要求填写下列空白:
(1)组装氯气发生装置时,应选用的仪器及导管为 (填写图中编号)。
(2)本实验进行时,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次为 。
(3)仪器①的橡皮塞上至少应有2个孔的原因是 。
(4)本实验需配置10mol·L-1的NaOH溶液500mL,用到的仪器除了托盘天平、烧杯外,还须用到的仪器有 (填仪器名称) ,定容时操作如图,则所配溶液浓度 (填“偏高”或“偏低”)。
(5)实验时仪器①中ClO-与H2O2反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com