
题目列表(包括答案和解析)
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250 ml溶液.
步骤二:取所配溶液25.00 ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 ml,滴定中MnO4-,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液19.98 ml
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、________、转移、洗涤并转移、________摇匀.
②加入锌粉的目的是________.
③写出步骤三中发生反应的离子方程式________.
④实验测得该晶体中铁的质量分数为________.在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量________.(选填“偏低”“偏高”“不变”)
(2)结晶水的测定将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误;________;________.
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250 mL溶液.
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO4-,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液19.98 mL
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、________、转移、洗涤并转移、________、摇匀.
②加入锌粉的目的是________.
③写出步骤三中发生反应的离子方程式________.
④实验测得该晶体中铁的质量分数为________.在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量________.(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误;________;________.
| (w2-w1)×112×10 |
| 160a |
| (w2-w1)×112×10 |
| 160a |

图1-5
(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第________族。
(2)步骤①加Fe的目的是:__________________________________________________;
步骤②冷却的目的是:_____________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是______________________;考虑成本和废物综合利用因素,废液中应加入_________处理。
(4)由金红石(TiO2)制取单质Ti,涉及的步骤为:
![]()
已知:①C(S)+O2(g)![]() CO2(g);ΔH=-393.5 kJ·mol-1
CO2(g);ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)![]() 2CO2(g);ΔH=-566 kJ·mol-1
2CO2(g);ΔH=-566 kJ·mol-1
③TiO2(S)+2Cl2(g)![]() TiCl4(s)+O2(g);ΔH=+141 kJ·mol-1
TiCl4(s)+O2(g);ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)![]() TiCl4(s)+2CO(g)的ΔH=______________。
TiCl4(s)+2CO(g)的ΔH=______________。
反应TiCl4+2Mg![]() 2MgCl2+Ti在Ar气氛中进行的理由是_______________________。
2MgCl2+Ti在Ar气氛中进行的理由是_______________________。

(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第_________族。
(2)步骤①加Fe的目的是___________________________;
步骤②冷却的目的________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是_________,考虑成本和废物综合利用因素,废液中应加入_________处理。
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
已知:①C(s)+O2(g)====CO2(g);ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)====2CO2(g);ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)====TiCl4(s)+O2(g);ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)====TiCl4(s)+2CO(g)的ΔH=__________。
反应TiCl4+2Mg====2MgCl2+Ti在Ar气氛中进行的理由是____________________。
A卷
1.C 2.B 3.C 4.B 5.B 6.C 7.B 8.A 9.B 10.A 11.A 12.C 13.C 14.B 15.B
16. ①Fe3++3H2O Fe(OH)3+3H+
②2Fe3++Fe=3Fe2+
③Fe3++SCN…=[Fe(SCN)]2+
Fe(OH)3+3H+
②2Fe3++Fe=3Fe2+
③Fe3++SCN…=[Fe(SCN)]2+
④Fe3++3NH3?H2O=Fe(OH)3+3NH4+ ⑤2Fe3++H2S=2Fe2++S↓+2H+(每个2分)
17. CH3OCH3+16OH--12e-=2CO32 -+11H2O;3O2+6H2O+12e-===12OH-;CH3OCH3+4OH-+3O2=2CO32 -+5H2O(每个2分)
18. (1)① Mg2+、SO42−、H+ ②Ba2+、NO3−、OH−;(全对给2分,答不全但答到H+ 或OH−得1分)
19. (1)0.2 mol(1分)(2)SO2、NO2(1分) (3)AC(全对给2分,答不全得1分)
20. (1)H2(1分)(2)①Fe+2H+=Fe2++H2↑②AlO2-+4H+=Al3++2H2O
③4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+或:Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+、 4Fe(OH)2+O2+2H2O=4Fe(OH)3(每个2分)
(3) Al3+和Na+(全对给2分,答不全得1分) (4) H2SO4、HNO3(全对给2分,不全得1分)
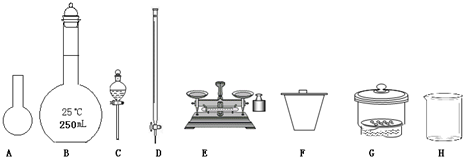
21. (1)ECDBAGF(2分);酚酞(1分);无色变为浅红色(或粉红色)且半分钟不褪去(2分);
(2)偏大(1分)(3)100.00mL容量瓶(1分)(4)偏小 偏小 偏大(每个1分)
(5)4.20mol/L(2分)
22. (1) 7g;8g;(2) 3.5mol/L
B卷
B卷:23.C 24.D 25.C 26.B 27.B 28.C 29.D 30.C
31.(1)3.6 mol (2)≥0(说明:答“任意值”可得分)(3)3.6 mol< n(SO3)≤4 mol(每个2分)
32. (1)NH4C1、① ;(2)NH4Cl和NH3?H2O(答NH4Cl和NH3也给分);NH4Cl和HCl;
(3)小于 大于;(每个1分)
33. (1)将Fe3+ 还原为Fe2+;析出(或分离、或得到)FeSO4?7H2O;(每个2分)
(2) FeSO4?7H2O 石灰(或碳酸钙、废碱);(每个1分)
 (3)TiO2+2C+2Cl2 TiCl4+2CO(2分);CO(1分);①TiCl4+2Mg△ㄔㄔTi+2MgCl2(2分);②防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分)③加入足量盐酸,除去金属镁,过滤,并用蒸馏水洗涤固体得金属钛。(2分)
(3)TiO2+2C+2Cl2 TiCl4+2CO(2分);CO(1分);①TiCl4+2Mg△ㄔㄔTi+2MgCl2(2分);②防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分)③加入足量盐酸,除去金属镁,过滤,并用蒸馏水洗涤固体得金属钛。(2分)
34. (1)0.6 mol/L (2分);(2)97.5mL(2分);(3)35mL(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com