
题目列表(包括答案和解析)
实验室用浓盐酸与
MnO2反应制备Cl2,再用Cl2与Ca(OH)2反应制取少量漂白粉.已知Cl2与Ca(OH)2反应制取漂白粉的反应是放热反应,温度稍高会发生副反应:6Cl2+6Ca(OH)2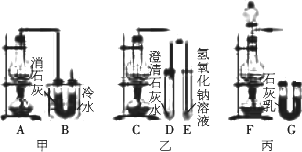
请从以下六个方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表.
a.反应不易控制
b.反应容易控制
c.有副反应发生
d.可防止副反应发生
e.容易污染环境
f.可防止污染环境
![]()


| 实验序号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② |
| |||||||||||||||
| |||||||||||||||
选择题
题号
1
2
3
4
5
6
7
8
答案
B
B
C
B
A
C
C
A
题号
9
10
11
12
13
14
15
16
答案
D
BC
AC
D
BC
A
A
C
17、(共8分、每空2分) (1)BD (2)碱式滴定管 (3)量筒 环形玻璃棒
18.(共20分)(1)浓盐酸的浓度随着反应的进行变稀以后,将不再反应(2分);加热时浓盐酸因挥发而损失(2分)
(2)① 无水硫酸铜(2分) 证明有水蒸气产生(2分)
白色变蓝色(其它合理答案也给分)(2分)②氯气无漂白性,次氯酸有漂白性 (2分)③吸收氯气(2分) ④Ag-+Cl-=AgCl↓(2分)
(3)F G(2分) 湿润的淀粉KI试纸(或湿润的有色布条)(2分)
19.(每空2分、共8分)(1)+1
(2)CuI 0.5
(3) 2 Cu2+
+ 5 I ―― 2 CuI + 1 I
―― 2 CuI + 1 I
20. (10分)
(1) Al2O3 ,Cl2
(2) 第三周期第ⅢA族
(3) Al(OH)3 + NaOH = NaAlO2 + 2H2O
(4)在常温下,铝的表面被浓硝酸钝化,生成一薄层致密、坚固的氧化物保护膜,从而阻止内部的金属继续与浓硝酸发生反应。所以铝不溶于冷的浓硝酸。
21、(10分)(1) (2分) 放热(2分)
(2分) 放热(2分)
(2)b、c (2分)
(3)不 (2分)
|