
题目列表(包括答案和解析)
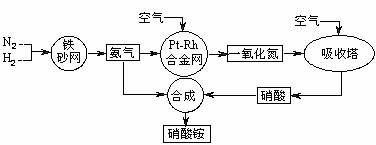
工业生产硝酸铵的流程图如下图。请回答:
(1)已知 :N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ?mol-1。
2NH3(g) ΔH=-92 kJ?mol-1。
①在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是________ _________。
②为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(2) 已知铂铑合金网未预热也会发热。写出氨催化氧化的化学方程式:_____________________________________________ _____________________,
该反应的化学平衡常数表达式K=___________,当温度升高时,K值____(增大、减小、无影响)。
(10分) 硝酸铵在工农业生产中有重要作用,如做氮肥。
请回答下列问题:
(1)已知N2(g) + 3H2(g) ![]() 2NH3(g) ;ΔH=-92 kJ?mol-1。请回答:
2NH3(g) ;ΔH=-92 kJ?mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量 92.4kJ (填“<”“>”或“=”)。
②为有效提高氢气的转化率,实际生产中宜采取的措施有 (填选项字母)
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(2)氨催化氧化是工业生产硝酸的重要反应,该反应的化学方程式
该反应的化学平衡常数的表达式K= ,当温度升高时, K值减小,则该反应是 (填“吸热”或“放热”)反应。
(3)将H2和N2按3:1的体积比混合于一定温度和压强的密闭容器中,当该反应达到平衡时,测得平衡混合气的平均式量为10,此时N2的转化率为 。(用百分数表示)已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)2NH3(g);△H=-92.0kaJ?mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是( )
A.吸收18.4KJ热量 B.放出18.4KJ热量
C.吸收73.6KJ热量 D.放出73.6KJ热量
 (08上海模拟)工业生产硝酸铵的流程图如下:
(08上海模拟)工业生产硝酸铵的流程图如下:
请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_______________________(任写一条)
(2)已知N2(g)+3H2(g)![]() 2NH3(g),ΔH=-92 kJ?mol-1。请回答:
2NH3(g),ΔH=-92 kJ?mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是_________________。
②为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(3) 已知铂铑合金网未预热也会发热。写出氨催化氧化的化学方程式。_______________________________________________________________________
该反应的化学平衡常数表达式K=________________,当温度升高时,K值______(增大、减小、无影响),其原因是_____________________________________。
(4)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为_______________。
(08上海模拟)工业生产硝酸铵的流程图如下:
请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_______________________(任写一条)
(2)已知N2(g)+3H2(g)![]() 2NH3(g),ΔH=-92 kJ?mol-1。请回答:
2NH3(g),ΔH=-92 kJ?mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是_________________。
②为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(3) 已知铂铑合金网未预热也会发热。写出氨催化氧化的化学方程式。_______________________________________________________________________
该反应的化学平衡常数表达式K=________________,当温度升高时,K值______(增大、减小、无影响),其原因是_____________________________________。
(4)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com