
题目列表(包括答案和解析)
Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度 ②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)NaOH溶液稍过量的原因 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 。
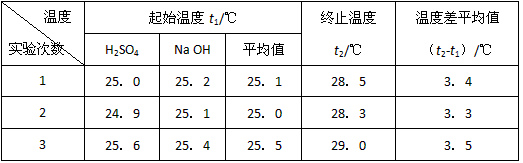
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,请根据实验数据求出中和热为 写出该反应的热化学方程式_________
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是
Ⅱ.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL
试填空:
(1)正确操作步骤的顺序是 (用字母表示)。
(2)观察滴定管液面的高度时应注意
(3)E步骤的操作中锥形瓶下垫一张白纸的作用是 。
(4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低”或“无影响”),原因是
(5)该烧碱样品纯度的计算式为_________________________。
Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度 ②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)NaOH溶液稍过量的原因 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 。
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,请根据实验数据求出中和热为 写出该反应的热化学方程式_________
|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
25.0 |
25.2 |
25.1 |
28.5 |
3.4 |
|
2 |
24.9 |
25.1 |
25.0 |
28.3 |
3.3 |
|
3 |
25.6 |
25.4 |
25.5 |
29.0 |
3.5 |
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是
Ⅱ.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL
试填空:
(1)正确操作步骤的顺序是 (用字母表示)。
(2)观察滴定管液面的高度时应注意
(3)E步骤的操作中锥形瓶下垫一张白纸的作用是 。
(4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低”或“无影响”),原因是
(5)该烧碱样品纯度的计算式为_________________________。
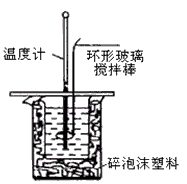
①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)NaOH溶液稍过量的原因 ____________。
(2)加入NaOH溶液的正确操作是_____________ (填字母)。
A.沿玻璃棒缓慢加入
B.一次迅速加入
C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是__________ 。
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,
请根据实验数据写出该反应的热化学方程式_____________ 。

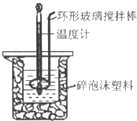 用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
1-5DBBD 6-13ABDCCADD 14AC 15A 16A 17D 18A 19A 20CD 21C
22、Ⅰ.(1)D
F(每空1分)(2) (3分)
(3分)
(3) 或
或 (3分)
(3分)
Ⅱ.(1)20.0 5.0 6.0×102 (每空2分,对有效数字不作要求)
(2)电路如图(4分、R0画错扣2分)


23解:(1)座椅开始做自由落体运动,1s内下落的高度为 (6分)
(6分)
(2)自由下落1s时,座椅的速度为v=gt=10m/s (2分)则座椅做匀减速运动的加速度为a=v2/2a=1m/s2 (2分)设受到的阻力为F,由牛顿第二定律知:F-mg=ma (2分)
所以阻力与重力的比值为F:mg=1.1 (4分)
24解:两板一起自由下落,机械能守恒,设M碰板时速度为v0,则: (3分),M与支架相碰,无机械能损失,M将原速率反弹,M将做竖直上抛运动,m向下做匀加速直线运动,直到绳绷紧,设经历时间
(3分),M与支架相碰,无机械能损失,M将原速率反弹,M将做竖直上抛运动,m向下做匀加速直线运动,直到绳绷紧,设经历时间 绳绷紧.对M经历时间
绳绷紧.对M经历时间 后的位移为:
后的位移为: (2分)m的位移为:
(2分)m的位移为: (2分)且:
(2分)且: (1分)解得:
(1分)解得: (1分)则绳绷紧前瞬间,M与m的速度分别为:
(1分)则绳绷紧前瞬间,M与m的速度分别为: (1分)
(1分) (1分)
(1分)
绳绷紧时内力远大于外力,动量守恒,设绷紧共同的速度为 ,则:
,则: (3分)求得:v=1/3m/s
(1分)
(3分)求得:v=1/3m/s
(1分)
因此绳绷紧过程损失的机械能为: (3分)
(3分)
说明:由于题中数据的关系,最后结果对单位不做要求,只要表示正确就给分。
25解:(1)所有电子在给定的磁场中做匀速圆周运动,由洛仑兹力提供电子做圆周运动的向心力: (4分)得:
(4分)得: (2分)(2)(8分)设电子进入磁场区的速度方向与x轴的夹角为θ,则出磁场的点P(x,y)满足:
(2分)(2)(8分)设电子进入磁场区的速度方向与x轴的夹角为θ,则出磁场的点P(x,y)满足: ,
, ,即:
,即: ,表明右下边界为图中的b。当θ=900和θ=00分别对应图中的a和c边界,因此所求的磁场区域为图中的阴影所示。说明:a和c边界各2分,b边界画出给4分。
,表明右下边界为图中的b。当θ=900和θ=00分别对应图中的a和c边界,因此所求的磁场区域为图中的阴影所示。说明:a和c边界各2分,b边界画出给4分。
 (3)图中阴影部分的面积为:
(3)图中阴影部分的面积为:

26.(15)⑴ (2分) ⑵硝酸铵(2分) NH4++OH―
(2分) ⑵硝酸铵(2分) NH4++OH―  NH3•H2O(3分)
NH3•H2O(3分)
⑶NH4+、H3O+(4分)(其它正确答案都可得分) ⑷N2O3(3分)
27(14分) (1)醋酸钾(2分) (2)Ba(OH)2+Na2SO4 === BaSO4 ↓ + 2NaOH(2分)(3)Ba(OH)2(2分) (4)= (2分)
(5)c(OH―)>c(Ba2+)=c(Cl―)>c(NH4+)>c(H+) 或c(OH―)>c(Cl―)=c(Ba2+)>c(NH4+)>c(H+) (3分)(6)2:3 (3分)
28.(本题13分)(1)确保硫酸被完全中和 (2分) (2)B (2分) (3)用环形玻璃棒轻轻搅动 (2分)
(4)H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1(3分)
 (5)大于(2分)
浓硫酸溶于水放出热量(2分)
(5)大于(2分)
浓硫酸溶于水放出热量(2分)
29.(18分)(1) (2分) (2) ① ⑤ (2分)
 (3)B→D:
……(3分)
(3)B→D:
……(3分)
|