
题目列表(包括答案和解析)
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)? △H= + 571.2 kJ?mol—1
BaS(s)= Ba(s)+S(s)? △H= +460 kJ?mol—1
已知:2C(s)+O2(g)=2CO(g)? △H= -221 kJ?mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s)? △H= ? ? 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为?? 。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
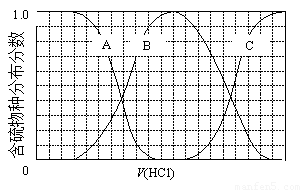
①含硫物种B表示???? 。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为 ? (填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 ? (用离子方程式表示)。
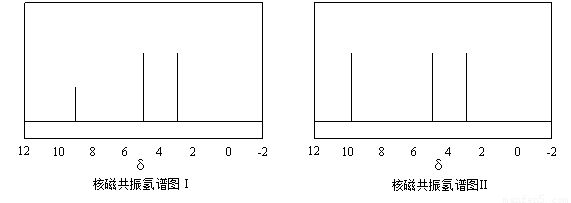
(4)硫的有机物(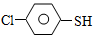 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
 及X的核磁共振氢谱如下图,其中???? (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中???? (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式:???? 。
的核磁共振氢谱图。写出X的结构简式:???? 。
| 1 |
| 2 |
| 1 |
| 2 |
| A、已知C(s)+O2(g)═CO2(g)△H1,C(s)+1/2O2(g)═CO(g)△H2;则△H1>△H2 | B、等量的H2在O2中完全燃烧,生成气态水比生成液态水放出的热量多 | C、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | D、由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H>0 |
| A、H2(g)+C12(g)=2HC1(g)△H=-184.6kJ/mol,1molH2与1molC12的能量之和小于2molHC1的能量 | B、燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1)△H=-4 bkJ | C、已知C(s)+O2(g)=CO(g)△H1;C(s)+1/2O2(g)=CO(g)△H2 则△H1>△H2 | D、已知CO(g)+H2O(g)=CO(g)+H2(g)△H=-41kJ/mol,则CO2(g)+H2(g)=CO(g)+H2O(g)△H=+41kJ/mol |
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
答案
D
B
A
A
C
D
C
D
B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个,该小题就为0分)
题号
10
11
12
13
14
15
16
17
18
答案
BD
C
B
C
C
CD
D
AD
AB
说明:非选择题的化学方程式、离子方程式中,化学式错、配平错,给0分;“↑”“↓”符号、条件等错漏扣一半分。
三、(本题包括3小题,共34分)
19.(10分)
(1) Cu2++ CO32-+H2O= Cu(OH)2 ↓+CO2↑
或CO32-+H2O HCO3-+OH-,Cu2++2OH‑=
Cu(OH)2 ↓ (2分)
HCO3-+OH-,Cu2++2OH‑=
Cu(OH)2 ↓ (2分)
(2)取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净。(2分)
(3)CuSO4、澄清石灰水 (各1分,共2分)
(4)B中无水硫酸铜变蓝,澄清石灰水不变浑浊(各1分,共2分)
(5) 实验结束后装置中残留的气体不能被吸收;装置中原有的空气有影响;石灰水可能会吸收空气中的CO2。(2分,答任一点即可)
20.(12分)
(1)取少量滤液加入试管中,先滴加KSCN溶液(1分),再滴加氯水(或双氧水、稀硝酸)(1分),溶液由浅绿色变为血红色(1分)。 (共3分,合理即给分)
(2)将Fe2+全部氧化为Fe3+(1分)
(3)Fe3++3OH―=Fe(OH)3↓(或Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+) (2分)
(4)过滤、冷却(各1分,共2分)
(5)①250mL容量瓶 (1分) ②b (1分)
(6) 69.5mg(2分)
21.(12分)
(l)假设2 :溶液中存在SO32―和HCO3―( 1分)
假设3、溶液中存在HCO3―和SO42―(2和3顺序不限。)(1分)
(2)
步骤编号
实验操作
预期现象和结论
①
用胶头滴管取少量溶液加入试管A中,再用滴管取过量的lmol/L氯化钡溶液并滴入其中(1分),充分反应,静置,然后将沉淀和上层清液分别装入另外的两支试管B、C中(1分)
产生白色沉淀,说明原溶液中含有SO42―或SO32―或两者都有(2分)
②
往装有沉淀的试管B中加入过量的2mol/L盐酸,将产生的气体通入品红溶液(1分)
沉淀部分溶解, 并产生气体. (1分)
品红褪色,说明原溶液中一定含有SO42―和SO32―(1分)
③
往装有上层清液的试管C中加入2mol/L盐酸;将产生的气体通入澄清石灰水(1分)
产生无色气泡, (1分)
澄清石灰水变浑浊,说明原溶液中含有HCO3―(1分)
④
其它方案合理给分
四、(本题包括3小题,共34分)
22.(11分)
(1) (2分)
C(NH3)(mol?L-1)
(2分)
C(NH3)(mol?L-1)
 (2)50% (2分)
(2)50% (2分)
(3)a、c (2分,答对1个1分,多选、选错为0分)
(4)向正反应方向(1分);不变(1分)
(5)(3分)如右图:
23.(11分)
(1)BaSO4(s)+4C(s)= BaS(s)+4CO(g);△H=+571.2 kJ•mol-1 (2分)
(2)S2-
+ H2O  HS- + OH-(2分)
HS- + OH-(2分)
(3)解:设每次用1.00L 2.0 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4
BaSO4+CO32-=BaCO3+SO42-
(2.0-x) mol•L-1 x mol•L-1
|