
题目列表(包括答案和解析)
(Ⅰ)化学平衡移动原理,同样也适用于其他平衡
(1)已知在氨水中存在下列平衡:NH3+H2ONH3·H2O
NH+OH-
向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度
向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是___________。
(2)氯化铁水解的离子方程式为___________________,向氯
化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程
式为________________,同时有红褐色沉淀生成,其原因是
_ ___________________________________________________________。
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象 ,原
因为
。
(Ⅱ)某二元酸 H2A 的电离方程式是:H2A=H++HA,HA-A2-+H+。回答下列问题:
(1)H2A是 (填“强电解质”或“弱电解质”或“非电解质”)
(2)Na2A 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方
程式表示) ;
(3)NaHA 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方
程式表示) ;
(4)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1 H2A溶液中氢离子的物质
的量浓度可能 0.11mol·L(填“<”、“>”或“=”),理由是: ;
(5)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是 。
NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向_______移动,OH-的浓度_______,NH![]() 的浓度_______。
的浓度_______。
(2)向氨水中加入浓盐酸,平衡向_______移动,此时溶液中浓度减小的粒子有_______、_______、_______。
(3)向浓氨水中加入少量NaOH固体,平衡向_______移动,此时发生的现象是_______。
下图是某化学兴趣小组的同学设计的制取NH3并进行NH3性质实验的改进装置。他们先称取mg固体氯化铵放入试管底部,再快速称取ng氢氧化钠固体盖在氯化铵表面,立即用带滴管的胶塞塞紧试管(滴管内事先吸入一定体积的浓氨水),慢慢挤压胶头滴管,立即看到试管内产生大量气泡。请回答有关问题:

(1)该化学兴趣小组的同学对用此装置制取NH3的原理进行了分析,你认为合理的是(填序号): ;
①浓氨水中存在平衡:NH3+H2O![]() NH3?H2O
NH3?H2O![]() NH+4+OH―,NaOH使平衡向左移动;
NH+4+OH―,NaOH使平衡向左移动;
②浓氨水中存在平衡:NH3+H2O![]() NH3?H2O
NH3?H2O![]() NH+4+OH―,NH4Cl使平衡向左移动;
NH+4+OH―,NH4Cl使平衡向左移动;
③NaOH溶于水时放热,温度升高,NH3的溶解度减小,有部分NH3逸出;
④NH4Cl和NaOH在此条件下反应,生成NH3。
(2)简述判断图中烧瓶内收满NH3的现象: ;
(3)该实验还能证明NH3的什么性质? 。

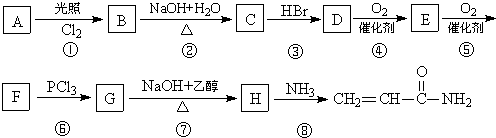

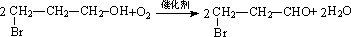

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com