
题目列表(包括答案和解析)
研究氮及其化合物具有重要意义。请回答下列问题:
(1)脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g) +NO(g) +NO2(g) 2N2(g)
+3H2O(g) △H<0,反应的氧化剂是________________。
2N2(g)
+3H2O(g) △H<0,反应的氧化剂是________________。
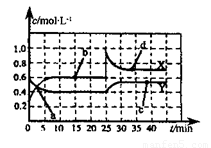
(2)巳知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
(3)25℃时,将NH3溶于水得100 mL0.1 mol • L-1的氨水,测得pH=11,则该条件下,NH3 • H2O的电离平衡常数Kb=_______。
(4)已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol;
2NO(g)+O2(g)=2NO2(g) △H=-112kJ/mol;
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol;
C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol。
则反应4CO(g)+2NO2(g)=4CO2 (g)+ N2(g) △H=________。
(5)用电化学法可获得N2O5。如图装置中,阳极的电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,则该电解反应的化学方程式为________________。


| 时间 \CO转化率 \温度 |
1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a1 | a2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com