
题目列表(包括答案和解析)
(10分)(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。
(已知:①CO(g)+ 1/2O2(g)=CO2(g) △H=-283.0KJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296.0KJ·mol-1 )
此反应的热化学方程式是 。
(2)硫—碘循环分解水制氢,主要涉及下列反应:
I SO2+2H2O+I2===H2SO4+2HI II 2HIH2+I2
III 2H2SO4====2SO2+O2+2H2O
分析上述反应,下列判断正确的是 。、
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1 molH2
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以丙烷(C3H8)为燃料制作新型燃料电池,电池的正极通人O2和CO2,负极通人丙烷.电解质是熔融碳酸盐。电池反应方程式为 。
(5)冶炼铜的反应为8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2
上述冶炼过程产生大量SO2。下列处理SO2的方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(10分)(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。
(已知:①CO(g)+ 1/2O2(g)=CO2(g) △H=-283.0KJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296.0KJ·mol-1 )
此反应的热化学方程式是 。
(2)硫—碘循环分解水制氢,主要涉及下列反应:
I SO2+2H2O+I2===H2SO4+2HI II 2HI H2+I2
H2+I2
III 2H2SO4====2SO2+O2+2H2O
分析上述反应,下列判断正确的是 。、
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1 molH2
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以丙烷(C3H8)为燃料制作新型燃料电池,电池的正极通人O2和CO2,负极通人丙烷.电解质是熔融碳酸盐。电池反应方程式为 。
(5)冶炼铜的反应为8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2
上述冶炼过程产生大量SO2。下列处理SO2的方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(1)已知: C(s)+O2(g)=CO2(g)???????? ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)? ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= ____? ___kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)? ΔH
CH3OH(g)? ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。A、B两点的平衡常数K(A)_______K(B)(填“>”、“=”或“<”,下同);由图判断ΔH _____0。

③某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25 mol/L,则CO的转化率=?????????? ,此温度下的平衡常数K=????????????? (保留二位有效数字)。
(3)工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为???????????????????????? 。
(1)能源的开发利用与人类社会的可持续性发展息息相关。
已知:① Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) △H1=a kJ/mol
②CO(g)+1/2 O2(g)=CO2(g) △H2=b kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=c kJ/mol
则C的燃烧热____________________________kJ.mol-1
(2)某实验小组模拟工业合成氨反应N2+3H2  2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
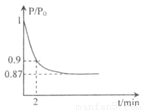
①反应达平衡的标志是(填字母代号)_____________
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为___________
③若提高N2的转化率可采取的措施有_______________
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中c(CO32-)=0.2mol/L,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol /L。
(5分)(1)下列数据是对应物质的熔点(℃)
|
NaCl |
Na2O |
AlF3 |
AlCl3 |
BCl3 |
Al2O3 |
CO2 |
SiO2 |
|
801 |
920 |
1291 |
190 |
-109 |
2073 |
-57 |
1723 |
据此作出的下列判断中,错误的是
A.铝的化合物晶体中没有离子晶体
B.表中只有BCl3,干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图所示。SiO2晶体中Si和Si—O键的比例为 。
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。
|
化学键 |
Si—O |
Si—Si |
O=O |
|
键能kJ/mol |
460 |
176 |
498 |
Si(s)+O2(g) SiO2(s),该反应的反应热△H=
。
SiO2(s),该反应的反应热△H=
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com