
题目列表(包括答案和解析)
某化工厂用接触法生成硫酸时,所用黄铁矿含FeS2为78%,在煅烧制备SO2时损失硫为6%,如果SO2生成SO3的转化率为90%,SO3的吸收率为90%,问生成500t 98%的浓H2SO4,在理论上需用这种黄铁矿多少吨?
某化工厂用接触法生产硫酸时,所用黄铁矿含FeS2为78%,在煅烧制备SO2时损失硫为6%,如果SO2生成SO3的转化率为90%,SO3的吸收率为90%.问生产500t 98%的浓硫酸,在理论上需用这种黄铁矿多少吨?
(1)设上述工厂只生产发烟H2SO4:
①算出1
②算出每1
(2)设上述工厂只生产98%的H2SO4:
①算出每1
②算出同时生产的98% H2SO4的质量。
注:上述气体体积均转化为标准状况下的体积。
(3)若该工厂同时生产发烟硫酸和98%硫酸(两种产物的质量比x=m1/m2,m1和m2分别是发烟硫酸和98%硫酸的质量)。
导出数学表达式,用来描述每1 000 m3出口气体中所消耗水的质量同上述x间的关系。
说明问题(1)和问题(2)中得到的有关数据是否符合你导出的数学表达式。
接触法制硫酸是先把SO2催化氧化成SO3,然后用浓硫酸吸收得到的SO3制取产品。某工厂生产硫酸时,进入接触室的原料气成分为SO27%、O2 11%、N2 82%(体积分数)。
(1)计算标准状况下10 m3原料气中的SO2物质的量______________mol。
(2)计算标准状况下1 0m3原料气的质量 千克。
(3)若SO2的转化率为99.2%,计算接触室导出的气体中SO3的体积分数 。
(4)若接触室导出的气体中含6.72%(体积分数)的SO3。把出口气体送进吸收塔,用
98.3%的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为20%的SO3)。计算吸收1000 m3出口气体(已折算为标准状况)所需要的98.3%的硫酸的质量 千克。
接触法制硫酸排放的尾气中,含少量的二氧化硫.为防止污染大气,在排放前设法进行综合利用.
(1)某硫酸厂每天排放的1万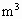 尾气中含0.2%(体积分数)的
尾气中含0.2%(体积分数)的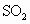 .用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(
.用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(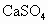 ·2
·2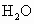 )?
)?
(2)如果将一定体积的尾气通入100ml 2mol·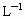 的氢氧化钠溶液中使其完全反应,经测定所得溶液含16.7g溶质.试分析该溶液的成分,并计算确定各成分的物质的量.
的氢氧化钠溶液中使其完全反应,经测定所得溶液含16.7g溶质.试分析该溶液的成分,并计算确定各成分的物质的量.
(3)某工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠.调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高亚硫酸氢钠的产量.现设n(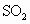 ),n(NaOH),
),n(NaOH),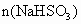 分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且
分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且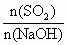 =x,试写出x在不同取值范围时,
=x,试写出x在不同取值范围时,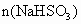 与n(
与n(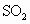 )、n(NaOH)间的关系式.
)、n(NaOH)间的关系式.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com