
题目列表(包括答案和解析)
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:
主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:

主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取氯化镁
C.第④步电解法制取镁是由于镁是很活泼的金属
D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
(2)步骤②不够合理,理由是
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36 L ,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7 g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为a L,该气体与上小题中所得气体的体积比等于 ∶ 。


硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl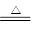 2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼:
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:___________________________________。
(2)E装置的作用是_______________________________________________。
如果拆去B装置,可能的后果是______________________________________
(3)写出D装置中发生反应的化学方程式:_____________________________
实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:__________________________________________________________;
实验室保存三氯化硼的注意事项是_________________________________。
(5)为了顺利完成实验,正确的操作是________(填序号),并解释原因:________。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:________________________________________________。
(选做题)(19分)图表法、模型法是常用的科学研究方法。
I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是 ,理由是 。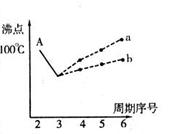
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。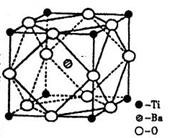
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置 。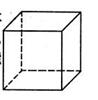
(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是 (填字母代号)
| A.氙的含量比较丰富 | B.氙的相对原子质量大 |
| C.氙原子半径大,电离能小 | D.氙原子半径小,电负性大 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com