A、B、C、D均为中学化学常见的纯净物,它们之间有如下转化关系(某些生成物已略去)
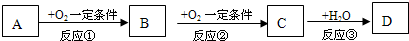
试回答:
(1)若A是非金属元素形成的化合物,且A与B、C在一定条件下都能反应生成一种无毒的气体.请写出下列化学方程式
①C→D
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
;②A和C反应
8NH3+6NO2=7N2+12H2O
8NH3+6NO2=7N2+12H2O
.
(2)若A是金属单质.
①向AlCl
3溶液中滴加D的水溶液,能看到的现象是
首先看到白色沉淀,而后沉淀溶解
首先看到白色沉淀,而后沉淀溶解
,理由是(用离子方程式表示)
Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=[Al(OH)4]-
Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=[Al(OH)4]-
;
②继续向所得溶液中通入足量的CO
2气体,可看到的现象是
有白色沉淀生成
有白色沉淀生成
,写出反应的离子方程式
[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
.







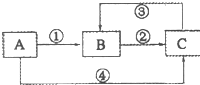 A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去).
A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去).
