
题目列表(包括答案和解析)
(13分)实验室用下列方法测定某水样中O2的含量。
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
① 打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 ;
② 用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③ 再分别从A 处注入含m mol NaOH溶液及过量的MnSO4溶液;
④ 完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤ 打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥ 重复④ 的操作。
⑦ 取下锥形瓶,向其中加入2~3滴 作指示剂;
⑧ 用0.005 mol · L—1Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为 (单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将 (填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是 。
(13分)实验室用下列方法测定某水样中O2的含量。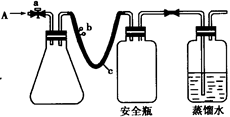
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为: I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 ;
②用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4 溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥重复④的操作。
⑦取下锥形瓶,向其中加入2~3滴 作指示剂;
⑧用0.005 mol · L—1Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为 (单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将 (填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是 。
(13分)实验室用下列方法测定某水样中O2的含量。

(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3 标准溶液滴定生成的I2,反应方程式为: I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
① 打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 ;
② 用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③ 再分别从A 处注入含m mol NaOH溶液及过量的MnSO4 溶液;
④ 完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤ 打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥ 重复④ 的操作。
⑦ 取下锥形瓶,向其中加入2~3滴 作指示剂;
⑧ 用0.005 mol · L—1Na2S2O3 滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3 标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为 (单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将 (填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是 。
(14分)在化学反应中,只要物质所含元素的化合价发生变化的反应就是氧化还原反应。例如:2Na+C12 =2NaCl,反应前后,Na元素、Cl元素的化合价分别发生了变化,该反应是氧化还原反应。
(1)根据化合价是否变化分析,下列反应(部分反应条件略去)属于氧化还原反应的是
(填写序号);
①C+O2 == CO2 ②CaO+H2O==Ca(OH)2 ③CaCO3==CaO+CO2↑
④2H2O2 == 2H2O+O2↑ ⑤CO+CuO=Cu+CO2 ⑥HCl+NaOH=NaCl+H2O
(2) 含有高价态元素的化合物,通常具有氧化性,如在氯化铁溶液中,氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁。试回答下列问题:
①该反应的化学方程式可表示为 ;
②向上述反应后的溶液中加入过量的锌粉充分反应后过滤,则滤纸上一定有的固体是
(写化学式,下同),滤液中的溶质是 。
(3) 通过进一步定量分析上述氧化还原反应的化合价变化发现:氧化还原反应中其元素化合价升高总数 (填“大于”、“等于”或“小于”)化合价降低升高总数。氟气是氧化性最强的非金属单质,在加热条件下,等物质的量的F2和烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是_______。 (写化学式)
(4)柠檬果汁中含有维生素C(C6H8O6,简写成Vc)是还原剂,它能被I2氧化生成C6H6O6。当前市场上测定柠檬果汁中Vc含量的方法是取10.00mL果汁,用醋酸酸化,再加入20.00mL 0.02500 mol?dm-3标准碘溶液,然后以淀粉溶液作指示剂,最后用0.01000 mol?dm-3Na2S2O3标准溶液滴定过量的I2,消耗Na2S2O3溶液10.00mL。
①Vc中碳元素的平均化合价是 。
②写出Vc与I2反应的离子方程式。
③此份果汁中含Vc= mg/100mL果汁。

请回答下列问题:
(1)写出A装置中玻璃仪器的名称:酒精灯、____________、____________。
(2)实验开始后,写出B中反应的离子方程式_____________________________________。
(3)C中的现象是________________________,E装置的作用是______________________。
(4)按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应。然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀

(5)在过滤沉淀时若过滤液出现浑浊,则必须要重复___________操作,若该学生没有重复该操作则测定的结果将___________(填“偏高”“偏低”或“无影响”)。
(6)要使测定结果准确,第一,装置气密性必须良好;第二,应先点燃___________处酒精灯(填装置字母)。
(二)下列有关化学实验的基本操作及安全知识的叙述,不正确的是_________(填序号)。
A.用托盘天平称取
B.附着于试管内壁的苯酚,可用碱液洗涤
C.用碱式滴定管量取20.00 mL 0.100 0 mol·L-1的高锰酸钾溶液
D.用渗析法分离淀粉中混有的NaNO3杂质
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
G.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
H.用重结晶法可以除去硝酸钾中混有的少量氯化钠
I.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
J.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com