
题目列表(包括答案和解析)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_______区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| 氟 | 氯 | 溴 | 碘 | 铍 |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl??????? B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
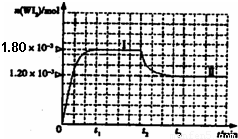
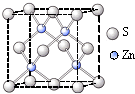
(7)已知CaF2晶体(见图)的密度为ρ g·cm-3,NA为阿伏加德罗常数,最近相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。

(12分)超支化聚合物由于具有高度独特的结构特征、合成方法和应用领域而引起了聚合物科学家们浓厚的兴趣。早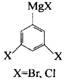 在1952年,Flory就首先在理论上论述通过ABx(如AB2)型单体分子间的缩聚制备高度支化大分子超支化聚合物的可能性。
在1952年,Flory就首先在理论上论述通过ABx(如AB2)型单体分子间的缩聚制备高度支化大分子超支化聚合物的可能性。
聚苯是超支化聚合物早期的研究结果,Kim等采用3,5-二卤代苯基格林氏试剂(AB2型单体,右图所示,A代表-MgBr、B代表-Br)经过渡金属催化合成了卤代苯封端的全芳基骨架超支化聚合物。
(1)由单体生成聚合物过程中,生成的无机副产物是 (化学式);
(2)为使得到的聚合物全部由卤代苯封端,反应中还应加入(少量的)一种物质_______(称为核分子,写结构简式),每合成一个聚合物分子,需要该核分子 个;
(3)该超支化聚合物分子中苯环数(n)与卤素原子数(m)的关系式 ;
(4)写出该超支化聚合物分子结构的片段(至少7个苯环)
(5)某聚酯的结构简式如右图。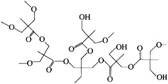 可由AB2型单体X在核分子Y存在下进行的熔融缩聚。写出X、Y的结构简式。
可由AB2型单体X在核分子Y存在下进行的熔融缩聚。写出X、Y的结构简式。
溴和海水提溴
1.溴的存在
地球上99%的溴元素以Br-的形式存在于海水中.溴被称为________.溴是海水中的常量元素.
2.卤族元素
F、Cl、Br、I等原子结构和元素性质有一定的相似性,通称为卤族元素.
3.溴单质和碘单质的物理性质
实验1:

实验2:碘受热不经液体直接变成了固体——升华.
由于液态溴容易挥发成溴蒸气,因此,常常在盛溴的试剂瓶里加一些水来防止溴挥发,贮于阴凉处密闭保存.
由于碘易升华,所以必须将碘置于阴凉处,密闭保存.
碘易升华的性质,常用于碘的制取和从混合物中的分离,提取指纹等.
4.氯、溴、碘单质氧化性的强弱
实验方案和实验记录:
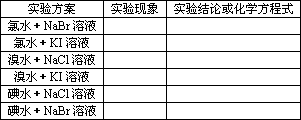
归纳整理1:氧化性:Cl2>Br2>I2(>S)
归纳整理2:Cl2可从溴化物的溶液里把Br2置换出来:
2Br-+Cl2![]() Br2+2Cl-
Br2+2Cl-
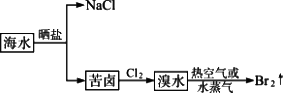
5.海水提溴的工艺流程
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com