
题目列表(包括答案和解析)
向20mL 盐酸和硫酸的混合溶液中,逐滴加入 0.1mol/L的 Ba(OH)2 溶液,沉淀的质量和溶液的pH值与加入的 Ba(OH)2 溶液体积的图像如下图所示(注意:起点时混酸的pH不为0)。回答:

(1)起始时,混合酸中硫酸的物质的量浓度是________mol/L,盐酸的物质的量浓度________mol/L。
(2)B点时沉淀的质量约是________g,
(3)A点时溶液中c(H+)为______mol/L;
(4)当酸碱恰好中和时,溶液中c(SO42-)为 mol/L。
已知Ksp(BaSO4)=1.1×10-10。
常温下,有关醋酸溶液的叙述中错误的是(双选) ( )。
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
B.将pH=3的醋酸稀释为pH=4的过程中,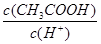 比值不变 比值不变 |
| C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| D.a mL pH=3的醋酸溶液与b mL pH=11的NaOH溶液恰好完全中和时,a=b |
(14分)Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1H2SO4 / mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液 / mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O / mL | V7 | V8 | V9 | 15 | 10 | 0 |
| 组别 | c(HA)/mo1·L-1 | c(NaOH)/mo1·L-1 | 混合液pH |
| 甲 | c | 0.2 | pH = 7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH = 9 |
NA代表阿伏加德罗常数的数值。下列有关叙述正确的是
A.50℃时,pH=1的1.0 L H2SO4溶液中含有的H+数目为0.1 NA
B.含4mol HCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2
C.室温下,21.0g乙烯和丁烯的混合气体中含有的氢原子数目为1.5NA
D.3.4g NH3中含N—H键数目为0.2NA
NA代表阿伏加德罗常数的数值。下列有关叙述正确的是
A.50℃时,pH=1的1.0 L H2SO4溶液中含有的H+数目为0.1 NA
B.含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2
C.室温下,21.0g乙烯和丁烯的混合气体中含有的氢原子数目为1.5NA
D.3.4g NH3中含N—H键数目为0.2NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com