
题目列表(包括答案和解析)
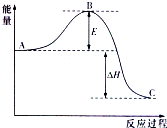 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.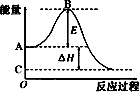
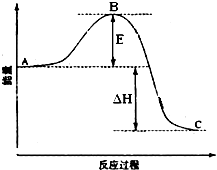 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题: 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.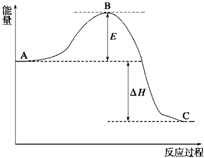 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
C
A
C
C
题号
9
10
11
12
13
14
15
答案
D
B
D
D
D
A
B
16.⑴ 2,4 ⑵相等,0.6 ⑶① n(D)>4/3 mol ② n(C)=3.6mol n(D) >17/15mol
⑷8∶5
17.10-14;10-12;1:9;pH(酸)+pH(碱)=13
18.⑴ 2FeSO4?7H2O Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
|