
题目列表(包括答案和解析)
(14分)在密闭容器中进行如下反应:3m A(g)+m B(g) n C(g)+q D(s)。
n C(g)+q D(s)。
(一)
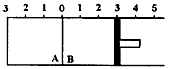
(1)若在起始容积相等的两个体积可变的容器中,充入物质的量相等的反应物(反应过程中保持体系的温度不变),建立如图所示的平衡,则由图可知:P1 P2(填“>”、“<”或“=”);m与n之间的关系为: (用含m的代数式表示n)。
(2)对(1)的反应而言,下列能够判断反应已达化学平衡状态的有 。
A.气体总的物质的量不变 B.固体D的物质的量一定
C.气体的密度不变 D.当气体A与B的物质的量之比为3:1时
E.气体A的浓度不变 F.反应速率v (A)=3m/nv(C)
(3)在一定的温度和压强下,将3moIA和1moIB充入体积可变的容器,达到平衡时,B的物质的量浓度为amol/L.现持续增大压强,有:
①当压强为平衡时的2.5倍时,B平衡时的物质的量浓度为C1 mol/L,测得C1=-2.5a;
②当压强为平衡时的10倍时, B平衡时的物质的量浓度为C2mol/L,测得C2= 5.5a;
试分析造成第②种结果的可能原因: 。
(二)若m=n=q,且保持原容器的体积不变,在一定温度下,将3molA和1mnolB充入该容器中,平衡时容器中B的转化率为W%。
(4)若在体积和温度不变的条件下,仅从生成物开始配料,要达到上述等数,则D的起始物质的量n(D)应满足的条件是____ (用含有W%的代数式表示,下同),平衡时C的转化率为 。
在密闭容器中进行如下反应:3m A(g)+m B(g)![]() n C(g)+q D(s)。
n C(g)+q D(s)。

(一)
(1)若在起始容积相等的两个体积可变的容器中,充入物质的量相等的反应物(反应过程中保持体系的温度不变),建立如图所示的平衡,则由图可知:P1 P2(填“>”、“<”或“=”);m与n之间的关系为: (用含m的代数式表示n)。
(2)对(1)的反应而言,下列能够判断反应已达化学平衡状态的有 。
A.气体总的物质的量不变 B.固体D的物质的量一定
C.气体的密度不变 D.当气体A与B的物质的量之比为3:1时
E.气体A的浓度不变 F.反应速率v (A)=3m/nv(C)
(3)在一定的温度和压强下,将3moIA和1moIB充入体积可变的容器,达到平衡时,B的物质的量浓度为amol/L.现持续增大压强,有:
①当压强为平衡时的2.5倍时,B平衡时的物质的量浓度为C1 mol/L,测得C1=-2.5a;
②当压强为平衡时的10倍时, B平衡时的物质的量浓度为C2mol/L,测得C2= 5.5a;
试分析造成第②种结果的可能原因: 。
(二)若m=n=q,且保持原容器的体积不变,在一定温度下,将3molA和1mnolB充入该容器中,平衡时容器中B的转化率为W%。
(4)若在体积和温度不变的条件下,仅从生成物开始配料,要达到上述等数,则D的起始物质的量n(D)应满足的条件是____ (用含有W%的代数式表示,下同),平衡时C的转化率为 。
| t/℃ | 25 | 125 | 225 | … |
| K | 4.1×105 | K1 | K2 | … |
| 实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
| N2 | H2 | NH3 | |||
| 1 | 650 | 2 | 4 | 0.9 | 9 |
| 2 | 900 | 1 | 2 | 0.3 | 0.01 |
| t/℃ | 25 | 125 | 225 | … |
| K | 4.1×105 | K1 | K2 | … |
| 实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
| N2 | H2 | NH3 | |||
| 1 | 650 | 2 | 4 | 0.9 | 9 |
| 2 | 900 | 1 | 2 | 0.3 | 0.01 |

 ,在B中充入
,在B中充入 ,在相同条件下发生可逆反应:
,在相同条件下发生可逆反应: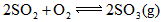
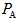 ,B中压强为
,B中压强为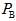 ,则
,则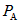 与
与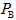 的
的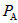 _________
_________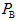 (填“大于”、“小于”或“等于”).
(填“大于”、“小于”或“等于”). 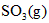 为x mol,A中
为x mol,A中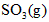 为y mol,则x和y的关系是
为y mol,则x和y的关系是
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
C
A
C
C
题号
9
10
11
12
13
14
15
答案
D
B
D
D
D
A
B
16.⑴ 2,4 ⑵相等,0.6 ⑶① n(D)>4/3 mol ② n(C)=3.6mol n(D) >17/15mol
⑷8∶5
17.10-14;10-12;1:9;pH(酸)+pH(碱)=13
18.⑴ 2FeSO4?7H2O Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
|