
题目列表(包括答案和解析)
(8分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是________________________________________________________________________
________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________。
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
(8分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是________________________________________________________________________
________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________。
|
滴定次数 |
待测溶液 体积(mL) |
标准酸体积 |
|
|
滴定前的刻度 (mL) |
滴定后的刻度 (mL) |
||
|
第一次 |
10.00 |
0.40 |
20.50 |
|
第二次 |
10.00 |
4.10 |
24.00 |
(5)下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
(1)下列实验操作或对实验事实的叙述中存在错误的是____________(填序号)。
A.用50 mL酸式滴定管准确量取25.00 mL KMnO4酸性溶液,放入锥形瓶中待用
B.在测定硫酸铜晶体的结晶水含量时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C.中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D.实验室中进行的下列实验均需水浴加热:
①苯的硝化反应 ②葡萄糖的银镜反应 ③乙酸乙酯的制备 ④淀粉、纤维素的水解
E.配制1 mol·L-1的NaOH溶液时,下列操作均会造成所配浓度偏低:①溶解后烧杯未多次洗涤 ②定容时仰视刻度线 ③容量瓶中原有少许蒸馏水
F.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
(2)某同学设计了如图所示测定红磷在氯气中燃烧产物的分子式的装置,该装置中B是底面积为100 cm2的圆筒状玻璃容器(密封盖上装有阀门),上面标有厘米单位的刻度,其他夹持装置已略去。(不考虑可逆反应)
操作步骤:
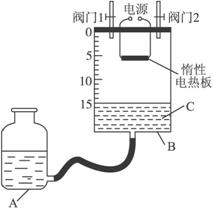
①检查装置的气密性
②将0.5 g红磷平铺在电热板上,盖紧容器
③打开阀门1、阀门2,从A的瓶口加入液体C,使B中液面至刻度15.0 cm
④向B中充入氯气,待氯气充满后关闭阀门1、阀门2,通电加热红磷……
请回答下列问题:
(i)检查装置气密性具体方法是____________________。
(ii)实验步骤③加入的液体C是____________(填名称)。
(iii)反应结束并充分冷却后,读取B中液面刻度读数时,应注意________________________;若液面在刻度5.6 cm处,此时实验条件近似看作标准状况,则生成物PClx中x的值是____________(计算结果保留1位小数)。
(11分)用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。
(A)甲基橙 (B)石蕊 (C)酚酞
(2)若选用甲基橙作指示剂,滴定终点的判断方法是
,此时溶液显 性。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1。]
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
| 第三次 | 10.00 | 0.40 | 21.50 |
(4)分析下列实验操作会对滴定结果产生的影响。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 。
③若烧碱溶液隔夜后滴定,选用甲基橙作指示剂时,则滴定结果 。
(11分)用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。
(A)甲基橙 (B)石蕊 (C)酚酞
(2)若选用甲基橙作指示剂,滴定终点的判断方法是
,此时溶液显 性。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1。]
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
| 第三次 | 10.00 | 0.40 | 21.50 |
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
C
A
C
C
题号
9
10
11
12
13
14
15
答案
D
B
D
D
D
A
B
16.⑴ 2,4 ⑵相等,0.6 ⑶① n(D)>4/3 mol ② n(C)=3.6mol n(D) >17/15mol
⑷8∶5
17.10-14;10-12;1:9;pH(酸)+pH(碱)=13
18.⑴ 2FeSO4?7H2O Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
|