
题目列表(包括答案和解析)
| 1 |
| 2 |
| 2MQ |
| m |
| 2MQ |
| m |
①CaCO3(s)=CaO+CO2(g);ΔH=177.7kJ
②C(g)+H2O(g)=CO(g)+H2(g);ΔH=-131.3kJ/mol
③0.5H2SO4(l)+NaOH(l)=0.5Na2SO4(l)+H2O(l);ΔH=-57.3kJ/mol
④C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol
⑤ CO(g)+ 1/2 O2(g)=CO2(g);ΔH=-283kJ/mol
⑥HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH=-57.3kJ/mol
⑦2H2(g)+O2(g)=H2O(l);ΔH=-517.6kJ/mol
(1)已知上述热化学方程式所给出的焓变绝对值没有错误,试从状态、反应放热或吸热等方面判断:在①——⑦中,不正确的有 ,不正确的理由分别是: 。
(2)根据上述信息,写出C转化为CO的热化学方程式:
。
(3)上述反应中,表示燃烧热的热化学方程式有 ,表示中和热的热化学方程式有 。
(4)已知1mol气态H2与1/2 mol气态O2反应生成1mol水蒸气,放出241.8kJ的热量;1mol气态H2与1/2 mol气态O2反应生成1mol液态水,放出285.8kJ的热量。写出上述两个热化学方程式。
 O2(g)=H2O(l)的△H=______kJ?mol-1,H2的燃烧热为______kJ?mol-1
O2(g)=H2O(l)的△H=______kJ?mol-1,H2的燃烧热为______kJ?mol-1| 1 |
| 2 |
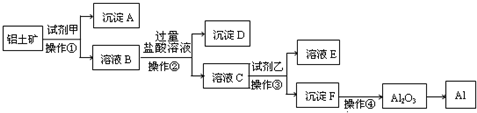
| ||
| 冰晶石 |
| ||
| 冰晶石 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com