
①CaCO3(s)=CaO+CO2(g);ΔH=177.7kJ
②C(g)+H2O(g)=CO(g)+H2(g);ΔH=-131.3kJ/mol
③0.5H2SO4(l)+NaOH(l)=0.5Na2SO4(l)+H2O(l);ΔH=-57.3kJ/mol
④C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol
⑤ CO(g)+ 1/2 O2(g)=CO2(g);ΔH=-283kJ/mol
⑥HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH=-57.3kJ/mol
⑦2H2(g)+O2(g)=H2O(l);ΔH=-517.6kJ/mol
(1)已知上述热化学方程式所给出的焓变绝对值没有错误,试从状态、反应放热或吸热等方面判断:在①——⑦中,不正确的有 ,不正确的理由分别是: 。
(2)根据上述信息,写出C转化为CO的热化学方程式:
。
(3)上述反应中,表示燃烧热的热化学方程式有 ,表示中和热的热化学方程式有 。
(4)已知1mol气态H2与1/2 mol气态O2反应生成1mol水蒸气,放出241.8kJ的热量;1mol气态H2与1/2 mol气态O2反应生成1mol液态水,放出285.8kJ的热量。写出上述两个热化学方程式。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ?mol-1 ②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ?mol-1 ③CaO(s)+CO2(g)=CaCO3(s) △H=-178.3kJ?mol-1 |
通入纯氧,主要化学反应: ④C(s)+O2(g)=CO2(g) △H=-393.8kJ?mol-1 ⑤CaCO3(s)=CaO(s)+CO2(g) K |
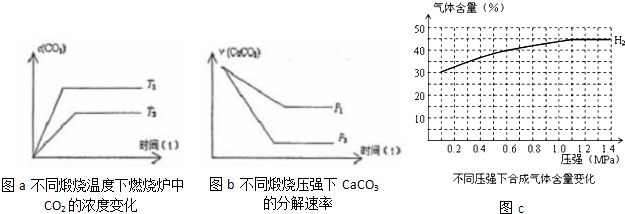
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、④ | C、②④ | D、②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com