
题目列表(包括答案和解析)
| ||
下图中甲、乙、丙的电极材料都是石墨和铁,其中丙是氯碱工业生产示意图。
若甲、乙两烧杯均盛放CuSO4溶液,
①甲中铁棒上的电极反应式为_______________________________________。
②乙装置工作一段时间后,向烧杯中加入适量的碱式碳酸铜【Cu2(OH)2CO3】,能使溶液恢复到起始状态,请写出这段时间内乙装置发生的所有反应的化学方程式
________________________________________________________________________。
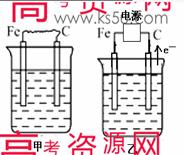
若甲、乙两烧杯均盛放饱和NaCl溶液,
①甲中石墨棒上的电极反应式为___________________。
②将湿润的淀粉碘化钾试纸放在乙烧杯______(填“Fe”或“C”)电极的上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应物Cl2和I2的物质的量之比为5∶1,且生成两种酸,则其对应的化学方程式为_________________________。
③假设产生的气体全部逸出溶液,当乙反应有0.01 mol电子转移后停止实验,此时烧杯中溶液的体积为100 mL,则溶液混合均匀后的pH = ____________。
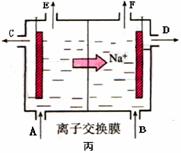
④当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常使用如丙图所示的装置,其中离子交换膜只允许Na+通过,Na+的移动方向如图中标注,则H2的出口是________(填代号)。
下图中甲、乙、丙的电极材料都是石墨和铁,其中丙是氯碱工业生产示意图。
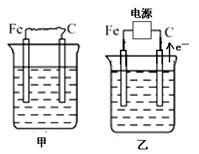
(1)若甲、乙两烧杯均盛放CuSO4溶液,
①甲中铁棒上的电极反应式为_______________________________________。
②乙装置工作一段时间后,向烧杯中加入适量的碱式碳酸铜【Cu2(OH)2CO3】,能使溶液恢复到起始状态,请写出这段时间内乙装置发生的所有反应的化学方程式
________________________________________________________________________。
(2)若甲、乙两烧杯均盛放饱和NaCl溶液,
①甲中石墨棒上的电极反应式为___________________。
②将湿润的淀粉碘化钾试纸放在乙烧杯______(填“Fe”或“C”)电极的上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应物Cl2和I2的物质的量之比为5∶1,且生成两种酸,则其对应的化学方程式为_________________________。
③假设产生的气体全部逸出溶液,当乙反应有0.01 mol电子转移后停止实验,此时烧杯中溶液的体积为100 mL,则溶液混合均匀后的pH = ____________。
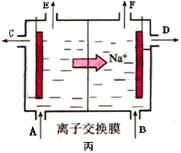
④当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常使用如丙图所示的装置,其中离子交换膜只允许Na+通过,Na+的移动方向如图中标注,则H2的出口是________(填代号)。
(16分) 下图中甲、乙、丙的电极材料都是石墨和铁,其中丙是氯碱工业生产示意图。
(1)若甲、乙两烧杯均盛放CuSO4溶液,
①甲中铁棒上的电极反应式为_______________________________________。
②乙装置工作一段时间后,向烧杯中加入适量的碱式碳酸铜【Cu2(OH)2CO3】,能使溶液恢复到起始状态,请写出这段时间内乙装置发生的所有反应的化学方程式
________________________________________________________________________。
(2)若甲、乙两烧杯均盛放饱和NaCl溶液,
①甲中石墨棒上的电极反应式为___________________。
②将湿润的淀粉碘化钾试纸放在乙烧杯______(填“Fe”或“C”)电极的上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应物Cl2和I2的物质的量之比为5∶1,且生成两种酸,则其对应的化学方程式为_________________________。
③假设产生的气体全部逸出溶液,当乙反应有0.01 mol电子转移后停止实验,此时烧杯中溶液的体积为100 mL,则溶液混合均匀后的pH = ____________。
④当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常使用如丙图所示的装置,其中离子交换膜只允许Na+通过,Na+的移动方向如图中标注,则H2的出口是________(填代号)。
(16分) 下图中甲、乙、丙的电极材料都是石墨和铁,其中丙是氯碱工业生产示意图。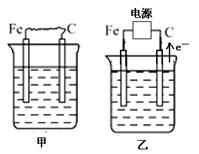

(1)若甲、乙两烧杯均盛放CuSO4溶液,
①甲中铁棒上的电极反应式为_______________________________________。
②乙装置工作一段时间后,向烧杯中加入适量的碱式碳酸铜【Cu2(OH)2CO3】,能使溶液恢复到起始状态,请写出这段时间内乙装置发生的所有反应的化学方程式
________________________________________________________________________。
(2)若甲、乙两烧杯均盛放饱和NaCl溶液,
①甲中石墨棒上的电极反应式为___________________。
②将湿润的淀粉碘化钾试纸放在乙烧杯______(填“Fe”或“C”)电极的上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应物Cl2和I2的物质的量之比为5∶1,且生成两种酸,则其对应的化学方程式为_________________________。
③假设产生的气体全部逸出溶液,当乙反应有0.01 mol电子转移后停止实验,此时烧杯中溶液的体积为100 mL,则溶液混合均匀后的pH = ____________。
④当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常使用如丙图所示的装置,其中离子交换膜只允许Na+通过,Na+的移动方向如图中标注,则H2的出口是________(填代号)。
一、1.B 2.BD 3.D 4.BD 5.CD 6.B?
7.解析:浓盐酸与足量的MnO2反应时,随着反应的进行,盐酸浓度变小,后者反应会停止,有一部分HCl不能转变成Cl2。
答案:B?
8.D 9.B?
二、10.(1)先变红,后褪色?
(2)2FeCl2+Cl2===2FeCl3 溶液由浅绿色变棕黄色?
(3)AgNO3+HCl===AgCl↓+HNO3 产生白色沉淀?
(4)Na2CO3+2HCl===2NaCl+H2O+CO2↑ 产生无色无味的气体?
(5)SO2+Cl2+2H2O===H2SO4+2HCl 氯水褪色?
(6)Mg+2HCl===MgCl2+H2↑ 产生无色无味气体?
11.(1)KCl Al Al(OH)3?
(2)2KCl+2H2O 2KOH+Cl2↑+H2↑
2KOH+Cl2↑+H2↑
(3)Al3++3ClO-+3H2O===Al(OH)3↓+3HClO?
12.(1)水 (2)无水CaCl2?
(3)白磷上残留的水溶解在酒精中,残留的酒精又溶解在醚中?
(4)用NaOH溶液吸收(装置图略)?
13.(1)2 4 ―― 2 2 1 2 H2O?
(2)② (3)0.2 (4)2.63?
14.9.18 kg?
15.m(KClO3)为61.25 g,m(MnO2)为6.09 g;c(Na2SO3)为0.14 mol?L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com