
题目列表(包括答案和解析)
实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:

(1)这些装置的连接顺序(按气体左右的方向)是 → →
→ → → → → (填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
(1)这些装置的连接顺序(按气体左右的方向)是 → →
→ → → → → (填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:

(1)这些装置的连接顺序(按气体左右的方向)是 → →
→ → → → → (填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
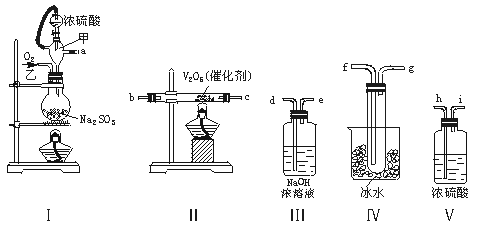
(1)这些装置的连接顺序(按气体左右的方向)是 → → → →
→ → → (填各接口的编号)。
(2)实验时甲仪器的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
实验室制取SO2的反应原理为:Na2SO3+H2SO4(较浓)= Na2SO4+SO2↑+H2O。
请用下列装置设计一个实验,将SO2转化为SO3:

(1)这些装置的连接顺序(按气体左右的方向)是a→ → → →
→ → (填各接口的编号)。
(2)以上实验装置存在的明显缺陷是缺少尾气吸收装置,请在方框内画出此装置,并标出所用试剂(自选)的名称:
 |
(3)实验时甲的作用是 。
(4)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。若在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(5)Ⅲ处观察到的现象是 。
一、1.BD 2.B 3.D 4.A 5.B 6.AC 7.D 8.AC 9.B?
10.解析:SO2 + 2NaOH===Na2SO3+H2O?
3 mol 6 mol 3 mol?
SO2 + NaOH===NaHSO3?
5 mol 5 mol 5 mol?
故n(SO2)∶n(NaOH)=(3+5)mol∶(6+5)mol=8∶11。?
答案:C
二、11.(1)②③⑤
(2)④
(3)①⑦⑧
(4)②⑤⑦⑧
(5)①
(6)⑥?
12.(1)氯气 二氧化硫?
(2)Cl2+2H2O+SO2===4H++2Cl-+SO
Ag++Cl-===AgCl↓
Ba2++SO ===BaSO4↓?
===BaSO4↓?
13.(1)a h i b c f g d?
(2)作用是使浓硫酸能顺利地滴入烧瓶中;原理是维持烧瓶内压强与分液漏斗内压强相等
(3)先加热V2O5,后缓缓滴入浓硫酸?
(4)有无色(或白色)晶体(或固体)生成?
(5)减小
(6) ×100%或
×100%或 ×100%
×100%
14.(1) (2)
(2) (3)
(3) <b<
<b<
15.(1)4 (2)
16.(1)a= (2)a=
(2)a= (3)
(3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com