
题目列表(包括答案和解析)
 A、B、C、D、E、F为原子序数依次增大的六种短周期元素.A、D处于同一主族,D、E、F处于同一周期,F原子的最外层电子数是A、B、D原子最外层电子数之和.C2-与D+核外电子层结构相同.A、B组成的常见气体X能使湿润的红色石蕊试纸变蓝;F的单质与X反应能生成B的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;E的单质既能与D元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐N;D、F可组成化合物M.
A、B、C、D、E、F为原子序数依次增大的六种短周期元素.A、D处于同一主族,D、E、F处于同一周期,F原子的最外层电子数是A、B、D原子最外层电子数之和.C2-与D+核外电子层结构相同.A、B组成的常见气体X能使湿润的红色石蕊试纸变蓝;F的单质与X反应能生成B的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;E的单质既能与D元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐N;D、F可组成化合物M. A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D.D和A形成简单离子后,它们的电子层相差两层.已知A处于第n族,D处于第m族,且A单质中只含共价键.B的气态氢化物的化学式为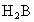 ,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等.C和A可形成
,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等.C和A可形成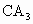 型化合物,C和A、B在同一周期,B与A左右相邻.试回答:
型化合物,C和A、B在同一周期,B与A左右相邻.试回答:
(1)若n-m=6,则A、D形成的化合物的电子式为________.
(2)D的原子序数为(用含m的代数式表示)________.
(3)C离子的结构示意图为________.
(4)向B的氢化物的水溶液中滴入A单质的水溶液,发生反应的化学方程式为________.
(5)向A、C形成的化合物中滴入氨水,其反应的离子方程式为________.
A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D.D和A形成简单离子后,它们的电子层相差两层.已知A处于第n族,D处于第m族,且A单质中只含共价键.B的气态氢化物的化学式为 ,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等.C和A可形成
,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等.C和A可形成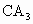 型化合物,C和A、B在同一周期,B与A左右相邻.试回答:
型化合物,C和A、B在同一周期,B与A左右相邻.试回答:
(1)若n-m=6,则A、D形成的化合物的电子式为________.
(2)D的原子序数为(用含m的代数式表示)________.
(3)C离子的结构示意图为________.
(4)向B的氢化物的水溶液中滴入A单质的水溶液,发生反应的化学方程式为________.
(5)向A、C形成的化合物中滴入氨水,其反应的离子方程式为________.
W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。

(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
A.M、X、Z形成的单质熔沸点 M>X>Z
B.氢化物的热稳定性:W>X
C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同
D.Z元素含氧酸的酸性一定强于Y元素的含氧酸
(3)元素W与M按原子个数比1:1形成的化合物A的电子式为______________。
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
(15分)现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是
(用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
一、1.D 2.C 3.C 4.D?
5.解析:
答案:C?
6.解析:看式量,要一个大于100,一个小于100即可。?
答案:CD?
7.B 8.A 9.D 10.B 11.C 12.C 13.C 14.D 15.D 16.A 17.B?
二、18.(1)CO2+C===2CO (2)Fe和FeO
CO2 (3)Fe和C
CO (4) <n<1
<n<1
(5)2/3?
19.(1)(E)(F)接(C)(D)接(A)(B)[或(B)(A)]接(I)(J)接(G)(H)?
(2)黑色CuO变红,无水硫酸铜变蓝 因为H2通过灼热的CuO后生成Cu和水蒸气,水蒸气使无水CuSO4变蓝。?
20.(1)5 5 (2)(a-10)∶(20-a) (3)10<a<20?
21.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com