
题目列表(包括答案和解析)
工业制硝酸的主要反应为:4NH3(g)+5O2(g) 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g)? △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的△H=???????????????????????? 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:

①反应在第2 min到第4 min时,O2的平均反应速率为?????????????????? 。
②反应在第6 min时改变了条件,改变的条件可能是????????? (填序号)。
A.使用催化剂????? B.升高温度? C.减小压强????? D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)达到平衡状态的是??????? (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是??????? (填序号)。
A.单位时间内生成n mol NO的向时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为____????? 。
②该电池正极的电极反应式为:???????????????????????? 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是?????????????????????????????????? (用相关的离子方程式表示)。

工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁。其生产流程如下:
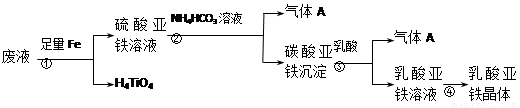
已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式 。步骤①中加入足量铁屑的目的是 。
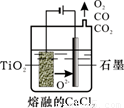
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。
(3)步骤②的离子方程式是 ,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是 。
(5)乳酸可由乙烯经下列步骤合成:
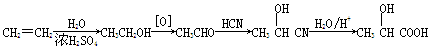
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468 kg乳酸亚铁晶体(M=234 g/mol)需要标准状况下的乙烯 m3。
工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁。其生产流程如下:
已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式 。步骤①中加入足量铁屑的目的是 。
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。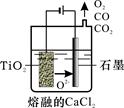
(3)步骤②的离子方程式是 ,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是 。
(5)乳酸可由乙烯经下列步骤合成:
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468 kg乳酸亚铁晶体(M=234 g/mol)需要标准状况下的乙烯 m3。
工业制硝酸的主要反应为:4NH3(g)+5O2(g) 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的△H= 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表: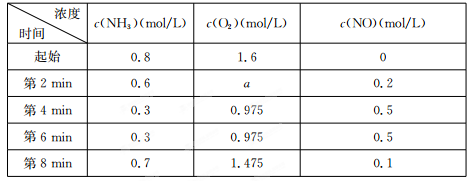
①反应在第2 min到第4 min时,O2的平均反应速率为 。
②反应在第6 min时改变了条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
A.单位时间内生成n mol NO的向时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。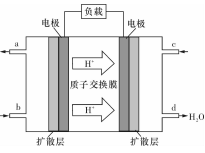
①该电池工作时,b口通入的物质为____ 。
②该电池正极的电极反应式为: 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是 (用相关的离子方程式表示)。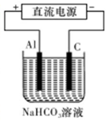
工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,此反应是放热反应。
NH3 + CO2 + H2O + NaCl(饱和) ![]() NaHCO3(晶体)↓+ NH4Cl
NaHCO3(晶体)↓+ NH4Cl
(1)某校学生实验小组利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体。C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
可选用的药品有:a.石灰石 b.生石灰 c.6 mol/L盐酸 d.稀硫酸 e.浓氨水
f.饱和氯化钠溶液。

①A中制备气体时,所需药品是(选填字母代号) ;
②B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为 ;
④检验D出口处是否有氨气逸出的方法是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:

①在操作II中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作III的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
例2.从某些性质看,NH3与H2O相当,NH4+与H3O+,NH2―与O2―都有相当关系,下列有关方程式不正确的是 ( )
A. NH4Cl+KNH2=KCl+2NH3↑
B. M+2NH3=M(NH2)2+H2↑(M为二价活泼金属)
C. 2NH4Cl+MNH=MCl2+NH3
D. 2NH4Cl+MO=M(NH2)2+2HCl+H2O
解析:A中KNH2可看成KOH,反应正确,B中NH3可看成H2O,反应正确,C中MNH可看成MO,反应同样也正确,而D中若将NH4Cl看成H3OCl即HCl,则有反应2NH4Cl+MO=MCl2+NH3↑+H2O
例 3.某化学课外小组所做实验的示意图如下图
3.某化学课外小组所做实验的示意图如下图
 图中“ ”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
图中“ ”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
(1) A中所用装置的主要仪器有
(2)B中所选的干燥剂是 ,作用是 。
(3)C中发生的主要反应的化学方程式是
(4)制取y气体的D装置所用的主要仪器是
制取y的化学方程式是 。
(1)当F中为紫色石蕊试液时,见到的现象是 主要反应方程式为 、 。
解析:解此题抓住两点:①产生C(或E)气体的条件为Pt丝红热②E内有红棕色即为NO2,得知M为NH3,y为O2,C中有NO、NO2、H2O(g)等。
答案:(1)大试管,铁架台(附铁夹),酒精灯,单孔塞和玻璃管。
(2) 碱石灰,既除去水蒸气又除去CO2.
 (3)4NH3+5O
(3)4NH3+5O
(4)平底烧瓶,分液漏斗,胶塞 ,导管(用锥形瓶代替平底烧瓶也可)
 2Na2O2 +2H2O
= 4NaOH + O2
2Na2O2 +2H2O
= 4NaOH + O2
(5)紫色石蕊试液变红,3NO2+H2O=2HNO3+NO,HNO3=H++NO ?3。
例4在室温时有50ml的混合气体,它们可能由HCl、NH3、CO2、NO组成。将这些混合气体通过浓H2SO4后体积减少为35ml ,再通过过量的过氧化钠气体体积又减少为20ml,最后将气体通过水,充分反应后只剩下10ml 气体。(所有气体体积在同温同压下测定)求:
① 混合气体由哪些气体组成?它们的各占多少毫升?
② 最后剩余气体是什么气体?
解析:50ml混合气体通过浓H2SO4体积减少为35ml,则NH3体积为50ml-35ml=15ml。由此确定无HCl。由题意可知还有CO2和NO。设含CO2为xml,NO为yml,若最后10ml为NO,则由:3NO2+H2O=2HNO3+NO可知需NO2为30ml>20ml,不合题意,若最后10ml为O2,则由4NO+3O2+2H2O=4HNO3可知ymlNO需消耗 ymlO2,再由2CO2+2Na2O2=2NaCO3+O2得生成O2为
ymlO2,再由2CO2+2Na2O2=2NaCO3+O2得生成O2为 ml,
ml, 解得
解得

则NH3为15ml,CO2为29ml,NO为6ml
答案:①混合气体由29mlCO2,15mlNH3,6mlNO组成。②剩余气体为O2,其体积为10ml.
例5 在密闭容器中,放入碳酸铵和氢氧化钠固体共Ag,将容器加热至
 解析:可能发生如下反应:
解析:可能发生如下反应:
(NH4)2CO2 + 2NaOH === 2NH3↑+ 2H2O + Na2CO3 ………①
(NH4)2CO3 === 2NH3↑+ CO2↑+ H2O↑……………………②
在加热过程中应首先发生反应①,只有当(NH4)2CO3过量时才能继续发生反应②。并由以上反应可以看出,NaOH过量时减重少,残留固体只有两种情况。一当(NH4)2CO3正好作用或过量时残留物为Na2CO3,二当NaOH过量时残留物为Na2CO3和NaOH的混合物,下面分别讨论。
10据反应(NH4)2CO3 + 2NaOH === Na2CO3 + 2NH3↑+ 2H2O↑
 96 80
96 80
176 106 34 36
A B
当A/B=176/106即A= B时,两者恰好反应
B时,两者恰好反应

20当NaOH过量时,即A> B时,根据减少质量确定(NH4)2CO3质量
B时,根据减少质量确定(NH4)2CO3质量

30当(NH4)2CO3过量,即A< B时,残留固体为Na2CO3,可确定参加反应的NaOH的质量。
B时,残留固体为Na2CO3,可确定参加反应的NaOH的质量。


答案:(1)当(NH4)2CO3过量或正好作用时
(2)当NaOH过量时,

4.实战演练
一、选择题:
1、下列气体中最易液化的是
A、N2 B、O
2、既能用浓硫酸,又能用碱石灰干燥的气体是
A、Cl2 B、SO
3、下列物质中既能与稀硫酸反应,又能与烧碱溶液反应的是
A、NH4Cl B、NH4HS C、NaHCO3 D、FeS
4、下列各组物质的空间构型完全不同的是
A、NH3和H3O+ B、NH4+和CH4
C、CO2和SiO2 D、金刚石和晶体硅
5、下列各组气体,在通常条件下能稳定共存的是
A、NH3、O2、HCl B、N2、H2、HCl
C、CO2、NO、O2 D、H2S、O2、SO2
6、某混合气体可能有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象),氢氧化钡溶液(有浑浊现象)。浓H2SO4、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,则可断定该混合气体中一定有
A、HCl、CO2、H2 B、CO、H2、H2O
C、CO、H2、NH3 D、HCl、CO、H2O
7、氨水中含氮的微粒最多的是
A、NH3 B、NH3?H2O C、NH4+ D、OH-
8、下列混合物可用加热方法分离的是
A、碘和氯化铵 B、硫酸钾和氯酸钾
C、氯化铵和硫酸钡 D、碳酸氢钠和碳酸氢铵
9、限用一种试剂,经过一次性实验就能鉴别Na2CO3、(NH4)2SO4、NH4Cl、KNO3溶液,应选用
A、AgNO3溶液 B、NaOH溶液
C、Ba(OH)2溶液 D、盐酸
10、下列各组离子在水溶液中能大量共存的是
A、CO32-、H+、HCO3-、Ca2+ B、NH4+、OH-、Ba2+、NO3-
C、I-、ClO-、NO3-、H+ D、SO32-、SO42-、Na+、OH-
二、填空
11、A、B、C三种气体,A为无色,在一定条件下A能与O2反应生成B;B不溶于水,它能与O2反应生成C;A、C气体均溶于水,其水溶液分别呈碱性与酸性。推断。A 、C 。
12、将aL含(NH4)2SO4与NH4NO3的混合液平均分成两份,向一份中加入b mol烧碱,加热恰好将其中NH3全部赶出,向另一份中加入BaCl2溶液完全反应。消耗c mol BaCl2,原溶液中NO3-的物质的量浓度为 。
三、计算
13、
350体积(标准状况)的氨气溶解在1体积的水里,求这种氨水的质量分数和物质的量浓度。(该氨水的密度为
【能力训练答案】
一、选择题
1、C 2、C 3、B C 4、C 5、B 6、A 7、B
8、C 9、C 10、D
二、填空
11、NH3、NO2
12、
三、计算
13、

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com