
题目列表(包括答案和解析)
 关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一是:“理论派”认为电解氯化铜溶液后溶液的pH升高.观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图曲线的关系.?请回答下列问题:
关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一是:“理论派”认为电解氯化铜溶液后溶液的pH升高.观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图曲线的关系.?请回答下列问题:| 水解 |
| 水解 |
| ||
| ||
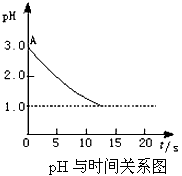
关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高。观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH值的变化如右图曲线关系。
请回答下列问题:
①电解前氯化铜溶液的pH值处于A点位置的原因是;________________________。(用离子方程式说明)
②“理论派”所持观点的理论依据是:____________________________________。
③“实验派”的实验结论是_________________,他们所述“精确实验”是通过______________确定的。
④你持何种观点?你所持观点的理由是(从化学原理加以简述)
____________________________________。

一、1.D 2.B?
3.解析:本题结合原电池原理考查实验现象。Fe作负极:Fe-2e-===Fe2+,C作正极:2H2O+O2+4e-===4OH-。
答案:B?
4.解析:本题要设计成原电池必须满足:①Fe作负极;②C、Pt或活动性比Fe弱的金属作正极;③电解质溶液中必须含Fe3+。
答案:CD?
5.C 6.D?
7.解析:正极反应MnO2+e-===MnO 。则n(MnO2)=n(e-)=
。则n(MnO2)=n(e-)=
答案:C?
8.BD 9.B?
二、10.(1)D (2)加CuSO4溶液后,构成Fe―Ag原电池,Fe溶解,质量减小;
Cu2+在银圈上得电子,沉积在Ag上,质量增加?
11.2CO2+O2+4e- 2CO
2CO 2CO+O2
2CO+O2 2CO2
2CO2
12.(1)H2 O2 2H2+4OH--4e-===4H2O?
O2+2H2O+4e-===4OH-?
(2)2H2-4e-===4H+ O2+4H++4e-===2H2O?
前者的pH变小,后者的pH变大。?
(3)CH4+10OH--8e-===CO +7H2O?
+7H2O?
4H2O+2O2+8e-===8OH-?
13.(1)反应速率可以用反应的消耗速率,也可以用产物的生成速率来表示?
(2)直线(y=0.05at)
抛物线(y′=bt )
)
(3)Ni 它的腐蚀速率随时间增长比镁慢?
14.(1)化学 电 离子 ①②③④?
(2)电解质 大 零?
(3)①二 ⅠA ②镉 负?
15.(1)Cu2++2H2O Cu(OH)2+2H+
Cu(OH)2+2H+
(2)因为Cu2++2e-===Cu,使Cu2+水解平衡向左移动,c(H+)减少,pH上升。
(3)pH降低 测定溶液pH?
(4)同意实验派观点;理由是CuCl2===Cu+Cl2↑
Cl2+H2O===HCl+HClO,使溶液酸性增强,pH降低。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com