
题目列表(包括答案和解析)
用NaOH(s)、水、大理石和盐酸制取33 g纯NaHCO3。
请参照物质的溶解度表回答下列问题:
(1)写出制取过程中反应的化学方程式。
(2)若提供100 g水,则需NaOH的物质的量为多少?
(3)简述实验的操作过程。
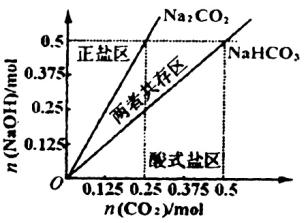
(4)在右图中反映上述实验过程的图象中,标出A点(即当![]() =
=![]() ,且n(
,且n(![]() )=0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
)=0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
请参照物质的溶解度表回答下列问题:
(1)写出制取过程中反应的化学方程式。
(2)若提供100 g水,则需NaOH的物质的量为多少?
(3)简述实验的操作过程。
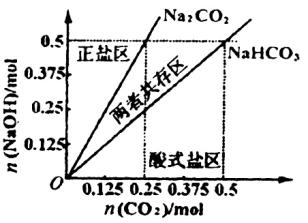
(4)在右图中反映上述实验过程的图象中,标出A点(即当![]() =
=![]() ,且n(
,且n(![]() )=0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
)=0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
(1)写出制取过程中反应的化学方程式。
(2)若提供100 g水,则需NaOH的物质的量为多少?
(3)简述实验的操作过程。
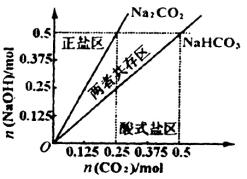
(4)在右图中反映上述实验过程的图象中,标出A点(即当![]() =
=![]() 且n(
且n(![]() )=)0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
)=)0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为: 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:一、1.解析:钠的焰色反应为黄色,钾的焰色反应为淡紫色,在观察钾的焰色时必须排除黄光的干扰。?
答案:D?
2.D?
3.解析:组成要符合(CO)n(H2)m的形式?
答案:D?
4.BC 5.C 6.D 7.C 8.C?
二、9.解析:在A中:1 mol NaHCO3分解生成0.5 mol CO2和0.5 mol H2O和0.5 mol Na2CO3,若先考虑0.5 mol CO2与Na2O2反应则有2CO2+2Na2O2===2Na2CO3+O2,故消耗0.5 mol Na2O2,生成0.5 mol Na2CO3,然后0.5 mol H2O和0.5 mol Na2O2刚好完全反应生成1 mol NaOH,故因为Na2CO3和NaOH不反应,结果相同,但应注意,若CO2过量,则CO2可和生成NaOH反应,而转化为H2O过量,因此通常在定量条件下先考虑CO2和Na2O2的反应情况。
答案:A.1 mol Na2CO3、1 mol NaOH B.1 mol Na2CO3 C.1 mol CaCO3、 1 mol Na2CO3 C>A>B?
10.(1)4KO2+2CO2===2K2CO3+3O2↑?
(2)0.61∶1 (3)1∶3?
(4)KO2 因等质量的KO2与CO2反应时放出的O2的量更多?
11.(1)O2?(2)2Na2O2+2H2O===4NaOH+O2↑?
(3)H2O2 催化剂 (4)浓H2SO4 干燥氧气?
12.4KO2+2CO2===2K2CO3+3O2?4RbO3+2CO2===2Rb2CO3+5O2 AB?
13.(1)0.5A (2)0.75A?
(3)0<x<0.5时,y=0.5A;0.5≤x<1时,y=xA

14.(1)2HCl+CaCO3===CaCl2+H2O+CO2↑ CO2+NaOH===NaHCO3?
(2)0.5 mol NaOH?
(3)称取20 g NaOH放入烧杯中,加100 g H2O,不断搅拌,使之溶解,等冷却后,通入过量CO2气体。过滤,用滤纸将滤渣表面的水吸干。?
(4)A点标注略 0.125 mol 正盐?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com