
题目列表(包括答案和解析)
 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:| c(H2)?c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
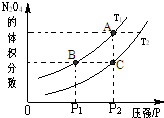
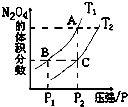 (1)反应2NO2(g)?N2O4(g)△H<0,在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.则T1
(1)反应2NO2(g)?N2O4(g)△H<0,在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.则T1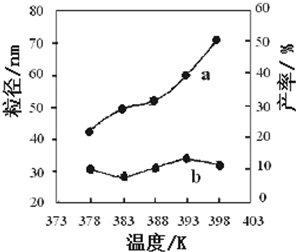 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究 实验②和 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |
在一密闭容器中加入A、B、C三种气体,在温度为T K和(T+10)K时,测得各物质的浓度如表.据此下列结论正确的是( )
| ||||||||||||||||||||||||||||||
一、1.BD 2.AD 3.A?
4.解析:2CO+O2 2CO2 ΔV
2CO2 ΔV
2 1 2 1
50 mL
若O2过量:V(CO)=100 mL;若CO过量:V(O2)=50 mL则V(CO)=150 mL。
答案:AB?

则CO%=50%。
答案:A
6.D 7.B 8.D 9.A?
二、10.(1)V(CO)=2(m-n)L V(O2)=(2n-m)L V(CO)=n L
V(O2)=(m-n)L?
(2)CO2、CO
11.BD
12.(1)672 mL (2)76 g?mol-1?
13.N2O NO 1∶4?
14.(1)t℃、p Pa时D的密度a g?L-1?
m(C)=30.5 g-a g?L-1×3 L=(30.5-3 a)g?
(2)盐酸的浓度b mol?L-1?
若Mg过量,V(H2)= ×22.4 L?mol-1
×22.4 L?mol-1
若HCl过量:
V(H2)= ×22.4 L?mol-1?
×22.4 L?mol-1?
若正好完全反应,V(H2)上述两值等效,均可。?
15.(1)4∶3 (2)0.91 g/L?
16.(1)1 固体的量增加,产生气体的量增加,说明在1中有酸剩余。?
(2)固体为Na2CO3和NaHCO3的混合物:
Na2CO3%=55.79% NaHCO3%=44.21%?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com