
题目列表(包括答案和解析)
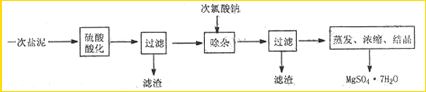
| SO | 2- 4 |
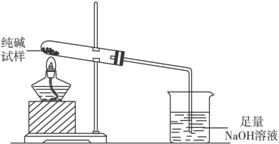
主要实验步骤如下:
①用天平准确称量出干燥大试管的质量为14.2 g,然后称取2.0 g已研碎的纯碱样品并放入干燥的试管中。
②用酒精灯慢慢加热,先从试管底部加热,然后将加热部位逐步前移,至烧杯中的导管口有气泡产生时,仍继续前移加热,使冷凝在试管壁上的水全部变成气体逸出。
③待试管冷却后,在天平上称出试管和碳酸钠的质量。
④加热,再称量,至两次称量误差不超过0.1 g为止,此时试管和碳酸钠的质量为15.9 g。
请填空和完成问题:
(1)停止加热前,要先把导管从烧杯中取出。目的是__________________________________。
(2)该试样中纯碱的质量分数的计算式为w(纯碱)=____________________________________。
(3)甲同学通过称量反应前后烧杯(含烧杯中的溶液)质量变化求算试样中纯碱的质量分数。甲同学求得的结果稍大于(2)所得的结果。原因是_______________________________________。
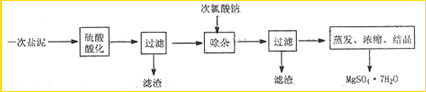
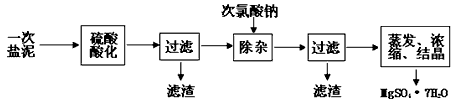
MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下:
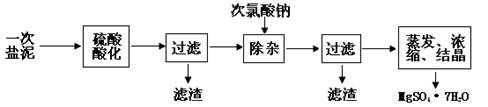
(1)用硫酸调整溶液pH到1~2,硫酸的作用是 。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是 (写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为: 。
(3)若除杂后过滤,发现滤液发黄,需采取的措施是 。
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是 。
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时。为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→ 。
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol·L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol·L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(SO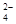 )=
。
)=
。
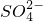 )=______.
)=______.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com