
题目列表(包括答案和解析)
(A)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。![]() 也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O![]() NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成
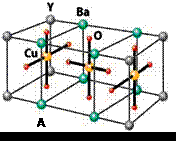
NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成![]() 。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:

(1)基态氮原子核外电子排布的轨道表示式为_____________。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为_____________。
(3)HN3属于_____________晶体,![]() 的空间构型是_____________,与
的空间构型是_____________,与![]() 互为等电子体的分子的化学式为_____________(写1种)。
互为等电子体的分子的化学式为_____________(写1种)。![]() 的电子式为____________,其中心原子的杂化类型是____________。
的电子式为____________,其中心原子的杂化类型是____________。
(4)![]() 中的键型为___________,超导氧化物A的化学式为___________。
中的键型为___________,超导氧化物A的化学式为___________。
(5)治癌药物B的结构简式为___________。
(B)以下是以绿矾、碳酸氢铵和氯化钾为原料制备生产市场较紧俏的硫酸钾产品的新工艺。已知:反应(Ⅰ)的化学方程式为:FeSO4·7H2O+2NH4HCO3![]() FeCO3↓+(NH4)2SO4+CO2↑+H2O
FeCO3↓+(NH4)2SO4+CO2↑+H2O
反应(Ⅱ)的化学方程式为:(NH4)2SO4+2KCl![]() K2SO4+2NH4Cl
K2SO4+2NH4Cl
工艺流程如下:

试回答下列问题:
(1)该工艺中的副产品是____________。(填化学式)
(2)操作C的名称为____________。
(3)原料绿矾、碳酸氢铵的最佳投料比是____________(质量比)时,FeSO4的转化率大于95%。
(4)物质甲是____________(填化学式),反应(Ⅲ)是甲物质与适量空气煅烧,温度为700—
(A)(10分)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3—也被称为类卤离子。用酸与
 叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼
金属,如溶解铜生成CuCl2—。铜和铂的化合物在超导和医药上有重要应用,
Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试
回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为 。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为 。
(3)HN3属于 晶体,N3—的空间构型是_____,与N3—互为等电子体的分子的化学式为 (写1种)。NH2—的电子式为 ,其中心原子的杂化类型是 。
(4)CuCl2—中的键型为 ,超导氧化物A的化学式为
(5)治癌药物B的结构简式为
(B)(10分)以下是以绿矾、碳酸氢铵和氯化钾为原料制备生产市场较紧俏的硫酸钾产品的新工艺 。已知:反应(Ⅰ)的化学方程式为:FeSO4??7H2O+2NH4HCO3= FeCO3↓+(NH4)2SO4+CO2↑+H2O
反应(Ⅱ)的化学方程式为:(NH4)2SO4+2KC1=K2SO4+ 2NH4Cl
工艺流程如下:
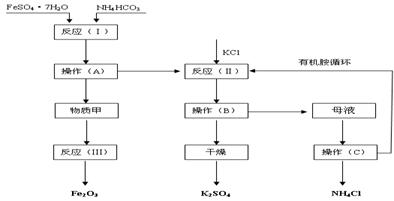
试回答下列问题:
(1)该工艺中的副产品是 。(填化学式)
(2)操作C的名称为 。
(3)原料绿矾、碳酸氢铵的最佳投料比是 (质量比)时,FeSO4的转化率大于95%。
(4)物质甲是 (填化学式),反应(Ⅲ)是甲物质与适量空气煅烧,温度为700~800℃,煅烧时间为1~1.5 h时可获得符合国标一级品要求的氧化铁红,其化学方程式是__________。
| ||
. |
| ||
. |
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
A.SO2和O3、PO43—和C1O4—互为等电子体
B.甲烷分子失去一个H+,形成CH3—,其碳原子的杂化类型发生了改变
C.Ti原子的核外电子排布式为[Ar]3d34s2
D.CS2、H2O、C2H2都是直线型分子
E.CH4、BCl3、CO2都是含有极性键的非极性分子
(II)(14分)
立方氮化硼是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐 ,比较下列原子的第一电离能:Be B,N O(填“>”“<”),其原因是 。
(2)下图为立方氮化硼的晶胞,则氮化硼的化学式为 ,该晶体中B原子填充N原子的 空隙。若该晶胞的边长为a cm,那么该晶体的密度为 g/cm3
(只要求列出算式)。
[来源:ZXXK]
(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因
。
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为 ,请在上方的方框中画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每种原子不少于7个)。
请完成下列各题:
(1)前4周期中,基态原子中未成对电子数为4的元素原子的电子排布式为________________。
(2)NaCl晶体中,与Na+等距离且最近的Na+有________________个。
(3)N 原子的第一电离能___________(填 “>”“<” 或“=”)O原子的第一电离能,N2分子中存在_______个σ键和_______个π键,NH3的沸点比PH3_________(填“高”或“低”),![]() 中N原子的杂化方式为________________,
中N原子的杂化方式为________________,![]() 的空间构型为________________。
的空间构型为________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com