(2011?上饶二模)氢氧化镁用于制药工业,还是重要的绿色阻燃剂.
I.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)
2.
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式为
Mg(OH)2+2H+=Mg2++2H2O
Mg(OH)2+2H+=Mg2++2H2O
;
II.已知:Mg(s)+2H
2O(g)=Mg(OH)
2(s)+H
2(g)△H
1=-441kJ?mol
-1H
2O(g)=H
2(g)+
O
2(g)△H
2=242kJ?mol
-1Mg(s)+
O
2(g)=MgO(s)△H
3=-602kJ?mol
-1(2)氢氧化镁分解的热化学方程式为
Mg(OH)2(s)=MgO(s)+H2O(g);△H=81KJ/mol
Mg(OH)2(s)=MgO(s)+H2O(g);△H=81KJ/mol
;
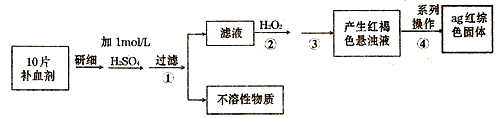
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁.

(3)步骤①中每消耗0.1mol保险粉(Na
2S
2O
4)转移0.6mol e
-,则此反应的离子方程式为
6Fe(OH)3+S2O42-+2OH-=6Fe(OH)2+2SO42-+4H2O
6Fe(OH)3+S2O42-+2OH-=6Fe(OH)2+2SO42-+4H2O
;
(4)已知EDTA只能与溶液中的Fe
2+反应生成易溶于水的物质,不与Mg(OH)
2反应.虽然Fe(OH)
2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)
2除去并获得纯度高的Mg(OH)
2.请从沉淀溶解平衡的角度加以解释
Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解.
Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解.
;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
| 精制阻燃剂的条件 |
阻燃剂铁含量 |
| 序号 |
提纯体系温度/℃ |
加入EDTA质量/g |
加入保险粉质量/g |
W(Fe)/(10-4g) |
| 1 |
40 |
0.05 |
0.05 |
7.63 |
| 2 |
40 |
0.05 |
0.10 |
6.83 |
| 3 |
60 |
0.05 |
0.10 |
6.83 |
| 4 |
60 |
0.10 |
0.10 |
6.51 |
(5)若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是
C
C
(填字母).
①40℃②60℃③EDTA质量为0.05g ④EDTA质量为0.10g⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤B.②④⑥C.①④⑥D.②③⑤



 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题: