
题目列表(包括答案和解析)
(10分)A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素。其中A中含有5个原子核,它们之间有如下的反应关系:

(1)A、D的电子式分别为:A  ,D
,D 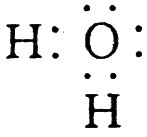 。
。
(2)B、C、D三种微粒结合质子能力x>y>z,(x、y、z分别代表B、C、D中的某一种微粒),则x、y、z分别代表的微粒符号为x OH- ,y NH3 ,z H2O 。
【解析】 A中含5个原子核,又由C+H+→A,推知A为NH![]() ,知C为NH3,B为OH-,D为H2O。
,知C为NH3,B为OH-,D为H2O。




| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


(12分)补铁药物“速力菲”说明书部分内容摘录:
【规格】每片含琥珀酸亚铁0.1g
【组成与性状】内含Fe2+34.0%~36.0%的无水碱式盐,为薄膜糖衣片
【适应症】用于缺铁性贫血症预防及治疗
【用量用法】成人预防量0.1g/日,治疗量0.2g~0.4g/日;小儿预防量30~60mg/日,治疗量0.1g~0.3g/日
【储藏】在避光、密封、阴凉处保存
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案:
 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因:________________________________________________ 。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:

(2)若试剂1为盐酸;则试剂2为________________________________。
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
[Fe(SCN)]2+络离子中的三价铁被还原为亚铁
② 。
(3)请你对其中一种可能进行实验验证:________________________________
实验方案(用文字述):________________________________________________ ,
根据预期现象判断结论:________________________________________________________ 。
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
|
序号 |
V(KMnO4)初 |
V(KMnO4)终 |
V(KMnO4) |
|
1 |
2.24mL |
14.25mL |
12.01mL |
|
2 |
0.30mL |
12.72mL |
12.42mL |
|
3 |
0.50mL |
12.53 |
12.03mL |
计算:该补血药中含Fe2+的质量分数________________(保留小数点后二位小数)。
(12分)补铁药物“速力菲”说明书部分内容摘录:
【规格】每片含琥珀酸亚铁0.1g
【组成与性状】内含Fe2+34.0%~36.0%的无水碱式盐,为薄膜糖衣片
【适应症】用于缺铁性贫血症预防及治疗
【用量用法】成人预防量0.1g/日,治疗量0.2g~0.4g/日;小儿预防量30~60mg/日,治疗量0.1g~0.3g/日
【储藏】在避光、密封、阴凉处保存
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案: 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因:________________________________________________。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:
(2)若试剂1为盐酸;则试剂2为________________________________。
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
[Fe(SCN)]2+络离子中的三价铁被还原为亚铁
② 。
(3)请你对其中一种可能进行实验验证:________________________________
实验方案(用文字述):________________________________________________,
根据预期现象判断结论:________________________________________________________。
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
| 序号 | V(KMnO4)初 | V(KMnO4)终 | V(KMnO4) |
| 1 | 2.24mL | 14.25mL | 12.01mL |
| 2 | 0.30mL | 12.72mL | 12.42mL |
| 3 | 0.50mL | 12.53 | 12.03mL |
计算:该补血药中含Fe2+的质量分数________________(保留小数点后二位小数)。
【规格】 每片含琥珀酸亚铁 【适应症】 用于缺铁性贫血症,预防及治疗用 【用量用法】 成人预防量 【贮藏】 避光、密封、在干燥处保存 |
(1)该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率超过10.00%即不能再服用。
①为了检验某药店出售的“速力菲”是否氧化,实验室应选用的检验试剂为__________(填试剂的名称);
②实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中,其他成分不与KMnO4反应)。请配平下列离子方程式。
__________![]() +__________Fe2++__________H+
+__________Fe2++__________H+![]() __________Mn2++__________Fe3++__________H2O
__________Mn2++__________Fe3++__________H2O
③称量上述含铁元素质量分数为20.00%的“速力菲”
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸。含
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com