
题目列表(包括答案和解析)
(1)pH
=3的盐酸a L,分别与下列3种溶液混合,充分反应后溶液呈中性:①pH=11的氨水b L;
②物质的量浓度为1×10-3 mol/L氨水c L;
③c(OH-)=1×10-3 mol/L的Ba(OH)2溶液d L;
试判断a、b、c、d的大小关系正确的是________
A.a=b>c>d
B.b>a=d>c
C.c>a>d>b
D.c>a=d>b
(2)
已知室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,两溶液中c(H+)·c(OH-)=________;各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液;各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液.(3)
同浓度的下列溶液:①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4,其中c(NH| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| c(A-) |
| 实验编号 | HA溶液体积(mL) | NaOH溶液体积(mL) | 混合溶液的pH |
| 甲 | 20.00 | 20.00 | a |
| 乙 | 20.00 | V | 7 |
| 丙 | 20.00 | 10.00 | <7 |
(11分)1866年H. Rithausen从谷胶的硫酸分解产物中分离出谷氨酸(![]() )。1890年L. Wollf合成并确定了它的结构,1908年池田菊苗从海带的热水提取物中分离出谷氨酸的钠盐(
)。1890年L. Wollf合成并确定了它的结构,1908年池田菊苗从海带的热水提取物中分离出谷氨酸的钠盐(![]() ),它才是具有鲜味的成分,即味精。
),它才是具有鲜味的成分,即味精。
10-1 谷氨酸的电离常数Ka1=6.46×10-3,Ka2=5.62×10-5,Ka3=2.14×10-10;pKa= -lgKa,所以pKa1=2.19,pKa2 = 4.25,pKa3 = 9.67。
目前工业上生产味精的方法有水解法、糖蜜提取法、淀粉发酵法及合成法等。当前我国生产的味精主要采用淀粉发酵法。
以发酵法生产的工艺流程如下:淀粉![]() 葡萄糖
葡萄糖![]() 发酵
发酵![]() 谷氨酸铵
谷氨酸铵![]() L-谷氨酸
L-谷氨酸![]() 谷氨酸-钠盐。
谷氨酸-钠盐。
若生成谷氨酸二钠盐,则不具有鲜味,所以工业生产中控制各阶段的pH是一项关键。
(1)Ka1、Ka2、Ka3相对应的基团各是哪个?
(2)计算谷氨酸等电点的pH(所谓等电点,就是谷氨酸呈电中性时所处环境的pH)。在下面正确的选项上画圈。
A.2.19 B.3.22 C.4.25 D.6.96
(3)中和、脱色、结晶时的pH应保持在多少?在下面正确的选项上画圈。
A.3.22 B.4.25 C.6.96 D.9.67
(4)用什么物质脱色?
10-2 味精中有效成分是谷氨酸钠,可用沙伦逊甲醛滴定法测定其含量。准确称取味精1.000g,加蒸馏水溶解后稀释到10.0mL;从中取2.0mL放入100mL锥形瓶中,加入2.0mL 36%的甲醛溶液,加入20mL水。以酚酞为指示剂,用0.1000mol/L的标准NaOH溶液进行滴定,消耗10.80mL。
(1)谷氨酸钠与甲醛反应得到化学式为C6H8NO4Na,写出结构简式。
(2)加入甲醛的目的是什么?
10-3 味精中往往会加入食盐,某学生设计如下实验方案测定NaCl含量:取味精样品5.0g,并溶于蒸馏水;加入足量用稀硝酸酸化的硝酸银溶液,使沉淀完全;过滤;用蒸馏水反复洗涤沉淀多次;将沉淀低温烘干、称量;重复操作3次,计算NaCl含量。
另一学生觉得这个实验方案的误差较大,且测定沉淀的质量很不方便。于是他设计了另一个实验方案来测定NaCl的含量。已知AgSCN是难溶于水的沉淀。
请简要写出测定NaCl含量的新方案。
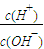 =1010,请回答下列问题:
=1010,请回答下列问题: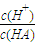 B.
B. C.c(H+)?c(OH-) D.c(OH-)
C.c(H+)?c(OH-) D.c(OH-)| 实验编号 | HA溶液体积(mL) | NaOH溶液体积(mL) | 混合溶液的pH |
| 甲 | 20.00 | 20.00 | a |
| 乙 | 20.00 | V | 7 |
| 丙 | 20.00 | 10.00 | <7 |
1.B 2.C 3.C 4.C 5.D 6.D 7.C 8.A 9.C 10.D 11.C 12.C 13.C 14.C 15.C 16.CD 17.B 18.B 19.D 20.A 21.CD 22.AB 23.A 24.CD 25.C
26.
(1)AgCl
(2) A是 Na2CO3 ,B是 HCl ,C是 AgNO3 ,
D是 BaCl2 ,E是 NaHSO4
27.(1) a . b
(2) 干燥氮气和氢气
使氮气.氢气混合,观察气泡产生的快慢调节氮气和氢气的比例
(3)不会, 混合气体中氨气的含量较小 。
(4)该反应是放热反应
(6) NO3- . NH4+
28
(1) 16
(2) 8mol
(3) 5:4
(4) 2:3
(5) 1:2
(6) 3:3:2
29.((1) 5.824 , 5.376
(2) (va+500)/140 mol/L。
(3) 57.
部分小题答案缺少
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com