
题目列表(包括答案和解析)
甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。

甲小组测得:反应前氧化铜的质量为![]() 、氧化铜反应后剩余固体的质量为
、氧化铜反应后剩余固体的质量为![]()
![]() 生成氮气在标准状况下的体积
生成氮气在标准状况下的体积![]() 。
。
乙小组测得:洗气前装置D的质量![]() 、洗气后装置后D的质量
、洗气后装置后D的质量![]() 、生成氮气在标准状况下的体积
、生成氮气在标准状况下的体积![]() 。
。
请回答下列问题:
(1)写出仪器a的名称: 。
(2)检查A装置气密性的操作时 。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③
|
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为 。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是 。 为此,乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果。该药品的名称是 。
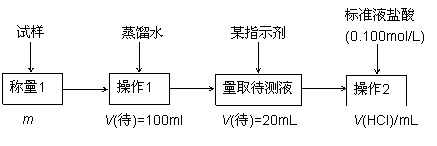
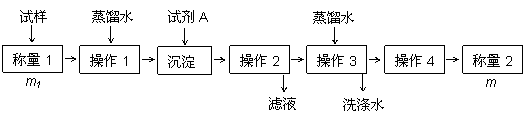
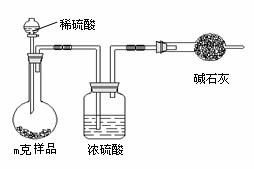
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
方法二:
 |
方法三:
 |
方法四:不使用化学试剂,使用实验室常用仪器。
按要求回答下列问题:
(1)方法一的操作1中要用到的玻璃仪器有烧杯、玻璃棒,还需要 ;操作2的名称是 ;该过程选择的指示剂是 ;该样品中NaHCO3的质量分数为 [用上图数据填写含m、V(HCl)的表达式]。
(2)方法二选择将HCO3- 离子转化为沉淀并称重,试剂A为 (填化学式)溶液;操作3的名称是 ;
如何判断这个目的已经达到: 。
(3)根据方法三中所用的实验装置,可判断需测定的实验数据是 ;仔细分析该实验装置,由此测得的数据计算出的实验结果有可能偏高也有可能偏低。
偏高的原因可能是 ;
偏低的原因可能是 。
(4)方法四的实验原理是 (用化学方程式表示)。
环境监测中,关于空气里SO2含量的测定有如下简易测定法:
(1)测定原理:SO2通入碘的淀粉溶液中,则溶液由蓝色变为无色,这是由于碘能氧化SO2,写出这一反应的化学方程式_____ ___。
(2)规定装置如图。

(3)测定方法:
①碘溶液的配制:为配制5×10-4mol•L-1的碘溶液,用分析天平准确称取________g粉末状的纯碘,并称取约4gKI(加入KI并不影响IZ溶液物质的量浓度的计量),
试回答,加入KI的目的是________,使之全部溶于水配成1000mL溶液,取此溶液50mL稀释10倍,其操作方法是______ __,即得到5×10-4mol•L-1的碘溶液。配好的碘溶液应存放在棕色玻璃瓶于冷暗处。
②测定:用移液管精确吸取5mL 5×10-4mol•L-1的碘溶液,注入图4的试管中,加2~3满淀粉指示剂,此时溶液呈蓝色。在测定地点(如硫酸厂、炼焦厂、居民集中的住宅区等),按图中装置连接好各仪器,徐徐抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气的次数。设抽气次数为n,经计算,空气中SO2的含量=1.6/n(mg•L-1)。空气中SO2允许含量不得超过0.02mg•L-1,则抽气次数n≥________次时该地点空气才符合标准,否则说明SO2含量超标,已造成空气污染。
(1)测定原理:SO2通入碘的淀粉溶液中,则溶液由蓝色变为无色,这是由于碘能氧化SO2,写出这一反应的化学方程式_____ ___。
(2)规定装置如图。
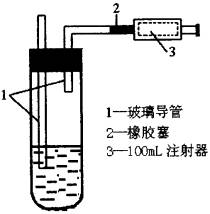
(3)测定方法:
①碘溶液的配制:为配制5×10-4mol•L-1的碘溶液,用分析天平准确称取________g粉末状的纯碘,并称取约4gKI(加入KI并不影响IZ溶液物质的量浓度的计量),
试回答,加入KI的目的是________,使之全部溶于水配成1000mL溶液,取此溶液50mL稀释10倍,其操作方法是______ __,即得到5×10-4mol•L-1的碘溶液。配好的碘溶液应存放在棕色玻璃瓶于冷暗处。
②测定:用移液管精确吸取5mL 5×10-4mol•L-1的碘溶液,注入图4的试管中,加2~3满淀粉指示剂,此时溶液呈蓝色。在测定地点(如硫酸厂、炼焦厂、居民集中的住宅区等),按图中装置连接好各仪器,徐徐抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气的次数。设抽气次数为n,经计算,空气中SO2的含量=1.6/n(mg•L-1)。空气中SO2允许含量不得超过0.02mg•L-1,则抽气次数n≥________次时该地点空气才符合标准,否则说明SO2含量超标,已造成空气污染。
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g) 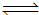 CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+ CO2(g)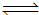 2CO(g)
△H=+172.5kJ•mol-1
2CO(g)
△H=+172.5kJ•mol-1
则CO(g)+H2O(g)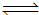 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)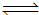 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
若用该电池提供的电能电解60mL NaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
 CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
|
温度/℃ |
起始量/mol |
平衡量/mol[学科 |
达到平衡所x需时间/min |
||
|
H2O |
CO |
H2 |
CO |
||
|
900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)
 2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
不同实验条件下反应,N2浓度随时间变化如下图1。


图1 图2
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com