
题目列表(包括答案和解析)
某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱。
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易生华;③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示。
| | 水 | 四氯化碳 |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |

某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱。
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易生华;③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示。
|
|
水 |
四氯化碳 |
|
溴 |
黄→棕 |
橙→橙红 |
|
碘 |
深黄→褐 |
紫→深紫 |
实验方案:该小组设计下图所示装置实验(夹持仪器已略去,装置气密性完好)
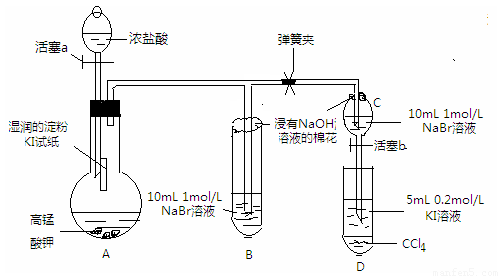
实验过程:
Ⅰ 先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ 当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ 当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ … …
回答以下问题:
⑴验证氯气的氧化性强于碘的实验现象是 ,写出该反应的化学方程式 ;
⑵为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ,写出
该反应的离子方程式 ;
⑶由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为 ;
⑷你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点
某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱。
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易生华;③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示。
|
| 水 | 四氯化碳 |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
实验方案:该小组设计下图所示装置实验(夹持仪器已略去,装置气密性完好)
实验过程:
Ⅰ 先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ 当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ 当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ … …
回答以下问题:
⑴验证氯气的氧化性强于碘的实验现象是 ,写出该反应的化学方程式 ;
⑵为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ,写出
该反应的离子方程式 ;
⑶由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为 ;
⑷你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com