
题目列表(包括答案和解析)
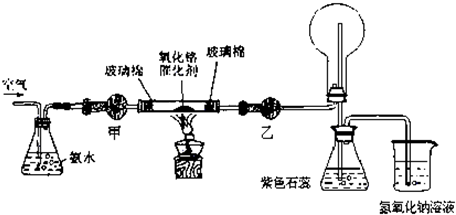
| ||
| 加热 |
| ||
| 加热 |
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
50ml 0.5mol·L-1的盐酸与50ml 0.55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
请回答下列问题: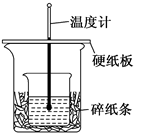
(l)从实验装置上看,由图可知该装置有不妥之处,应如何改正? 。
(2)烧杯间填满碎纸条的作用是 。
(3)如果不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(5)用相同浓度和相同体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会 (填“偏大”“偏小”“无影响”);
简述理由 。
A.进行中和热测定时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.用洁净铂丝蘸取固体配制的溶液,置于酒精灯火焰上灼烧,火焰呈黄色,肯定无钾元素
D.欲量取20.00 mL溴的四氯化碳溶液,现取一支25 mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00 mL处,用手挤压玻璃球,放溶液到21.00 mL处
E.检验红砖中的氧化铁成分时,在红砖粉末中加入稀盐酸,静置后取上层清液,再滴加2—3滴硫氰化钾溶液
F.氢气还原氧化铜实验中,先通氢气后加热氧化铜
G.用镊子取出白磷并置于水中切割
H.实验室做钠的实验时,余下的钠屑投入到废液缸中
I.中和滴定时,酸式滴定管用蒸馏水清洗3次后,再加入标准盐酸进行滴定
J.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
K.用冰醋酸、蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com