
题目列表(包括答案和解析)
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)
________.
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:


该实验探究的是________对化学反应速率的影响.在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是________(用实验序号填空).
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.
取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液.将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是________.
(10分,每空2分)甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)
。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。 实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
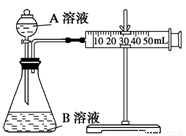
|
序号 |
A溶液 |
B溶液 |
|
① |
2 mL 0.1 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
|
② |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
|
③ |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。
取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
(10分,每空2分)甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)
。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。
取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
(10分,每空2分)甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)

 。
。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表: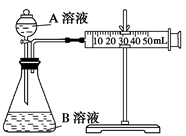
| 序号 | A溶液 | B溶液 |
| ① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
 mol/L
mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合
H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合 并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
 。
。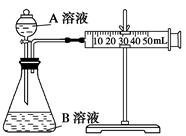
| 序号 | A溶液 | B溶液 |
| ① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
 mol/L
mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合
H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合 并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com