
题目列表(包括答案和解析)


| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
 第29届奥运会祥云火炬的外壳材料是高强度的铝镁合金.某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数,他们利用盐酸、氢氧化钠溶液设计了三种不同的实验方案:
第29届奥运会祥云火炬的外壳材料是高强度的铝镁合金.某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数,他们利用盐酸、氢氧化钠溶液设计了三种不同的实验方案:| NaOH溶液 |
| 盐酸 |
| 盐酸 |
| 过量NaOH溶液 |
| 过滤、洗涤、烧灼、冷却 |
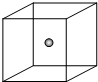 第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似.试回答:
第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似.试回答:
 HClO+H++Cl-
HClO+H++Cl- HClO+H++Cl-
HClO+H++Cl-1、B 2、C 3、、C 4、A 5C 6、B 7、C 8、D 9、B 10、BC 11、C 12、BD 13、AC 14、B的
15.题答案:(10分)(每空2分)
(I)(1)10600n/197m% (2)沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次 (3)① 加入BaCl2溶液,生成的沉淀质量大,测量的相对误差小;②过量的Ca2+可与OH-生成微溶的Ca(OH)2沉淀影响测定结果
(II)(1)4 (2)① 装置中原有空气中的CO2没有排出,最终也被碱石灰吸收 ②反应完成后,装置中的CO2没有全部被碱石灰吸收 ③空气中的CO2和水蒸气被碱石灰吸收
16.16(12分)
(1)Al2O3 + Na2CO32NaAlO2 +CO2↑;(2分)
(2)NaFeO2 + 2H2O = Fe(OH)3↓ + NaOH(2分)。
(3)由于溶液在硅酸钠和偏铝酸钠发生水解,降低pH值有利于水解平衡向正反应方向移动,当pH调到7~8时,使它们水解完全,从而除去SiO32-和AlO2-。(共2分)
(4)2CrO42-+2H+ Cr2O72-+H2O(2分)
(5)①当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去,半分钟内不复现(2分)
②94.08%(2分)。
17、(共10分)
(1)HNO3 Ag (每空1分)
(2)氧气 氢氧化铜悬浊液(或其他合理答案) (每空2分)
(3)①4Ag++2H2O = 4Ag↓+4H++O2↑ (2分)
②HCHO+2Ag(NH3)2++2OH- HCOO-+NH4++2Ag↓+3NH3+H2O (2分)
18.(8分)
(1)BD(2分)
(2)C (1分)该反应达到平衡时,平衡常数K=,增大容器体积时,c(CH3OH)和c(CO)等比例减小,由于H2浓度不变,此时的值仍然等于K,所以平衡不移动。(1分)
(3)越高(1分)
原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高碳转化率又降低且有甲烷生成。(1分)
(4)温度 压强 CO和H2的体积分数之比 (2分)
19、(共12分)
(1) 取代(或水解) 消去(每空1分)
(2) (2分)
(3)+ NaOH
(4)(2分,对1 个即可)
(5)(4分。到(CH2=CH)2CuLi给2分,到苯乙烯给3分,到聚苯乙烯给4 分,漏条件整体扣1 分)
20.(共8分)(1)由题意知(C6H10O5)n+nH2O 3nCH4↑+3nCO2↑
162n 3n
(2)要保证CO和H2的充分利用,则只能是生成的CO和H2必须是1:2。在100m3的天然气中有CH495m3和CO25m3。解设通入的水蒸气为Xm3,则有
CH4+CO2→2H2+2CO CH4+H2O→3H2+CO
5 5 10 10 X X 3X X
2CH4 + O2→ 4H2 + 2CO
95-5-X 2(95-5-X) 95-5-X
所以有,可以得出X=10(m3),
(3)80.5t
21.(共12分)
(1)平面正三角形(1分) N>S>Si(1分)
(2)N2O4(1分) 第四周期ⅤA(1分) 3d54s2(1分)
(3) N2,CO,C22-,CN-(4个中任选3个,每个1分) 1(0.5分) 2(0.5分)
(4)4(1分) 8(1分) 8(0.5分) 16(0.5分)
解析:(1) SiO32-、SO32-、NO3-三种离子中中心原子的杂化类型均为sp2杂化,离子构型为平面正角形,键角为120°(3)π键和σ键共存在,多重键中只有一个是σ键,其余均为π键,如双键中有1个σ键和1个π键,叁键中有1个σ键和2个π键。(4)PO43-中P原子以4个sp3杂化轨道和4个O原子成键,所以P为4配位氧。根据题意可先计算出Si晶胞中Si原子数:8×+6×+4=8(个),SiO2晶胞中Si原子数目与硅晶胞中Si原子数目相同,再可结合SiO2晶体中硅氧原子数目1:2的特点可确定晶胞中O原子数有16个(对题中描述的复杂结构可视为干扰条件)。
21B.答案:(1) MnO2 + 4H+ + 2Cl- = Mn2+ + Cl2 + 2H2O (1分)
(2) 假设一 氯气使布条褪色 假设二 HClO使布条褪色 假设三 盐酸使布条褪色
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色;
实验②把红色布条伸入稀盐酸中,红色布条不褪色 (每空1分)
结论:次氯酸使布条褪色 (1分)
(3) 下层液(1分) 上层液 (1分)
(4)会造成环境污染 (1分) (或其它合理答案) (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com