
题目列表(包括答案和解析)
先阅读下列短文,再回答下列问题:
在酸性条件下,次氯酸钠(NaClO)、过氧化氢都有很强的氧化性,可将Fe2+氧化为Fe3+。Mg(OH)2和Fe(0H)3在溶液中生成时呈胶状物或絮状物沉淀,而MgCO3在水中煮沸可转变为Mg(OH)2。“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质。若以它为原料,按下图工艺流程即可制得“轻质氧化镁”。若要求产品不含杂质离子,而且成本较低,流程中所用试剂或pH控制可参考表1、表2来确定。
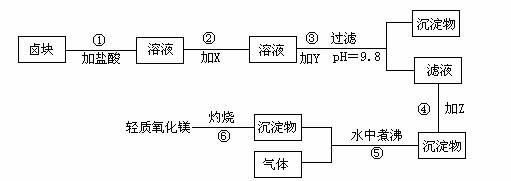
表1: 表2:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)3 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 工业品 | 规格 | 价格(元/吨) |
| 漂液 | 含NaClO 25.5% | 450 |
| 过氧化氢 | 含H2O2 30% | 240 |
| 烧碱 | 含NaOH 98% | 2100 |
| 纯碱 | 含Na2CO3 99.5% | 600 |
| 卤块 | 含MgCl2 30% | 310 |
请填下列空白:
(1)写出盐酸溶液中NaClO将FeCl2氧化成FeCl3,同时生成NaCl和H2O的化学方程式:
,写出在盐酸溶液中H2O2将FeCl2氧化成FeCl3,同时生成H2O的化学方程式: 。
(2)在步骤2中加入物质X,最佳的选择应是 ,理由是
。
(3)在步骤3中加入的物质应是 ,之所以要控制pH=9.8,其目的是
。
(4)在步骤4中加入物质应是 。
(5)在步骤5中发生的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com