
题目列表(包括答案和解析)

 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
| ||
| ||
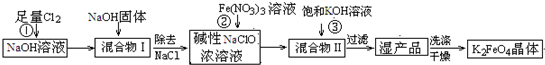


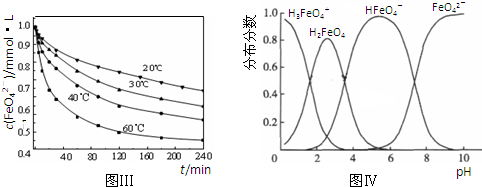
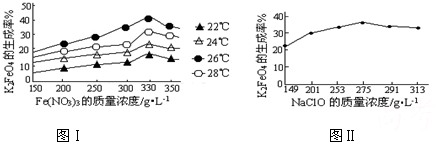
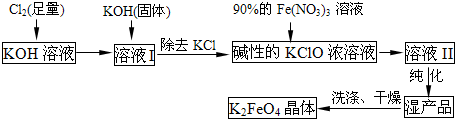
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式
,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式
,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
一、单项选择题
1.D 2.C 3.B 4.C 5.D 6.C 7.A 8.B
二、不定项选择题
9.D 10.BC 11.D 12.AC 13.CD 14.A
三、非选择题(本题包括6小题,共60分)
15.(12分)
(1)500mL容量瓶 (1分)、玻璃棒(1分) 淀粉溶液 (1分)
(2)碱式(2分) 滴入最后一滴硫代硫酸钠溶液,溶液蓝色褪去,且半分钟内不恢复。(2分)(3)为保证I-全部转化为I2,所加氧化剂应稍过量。如果选用新制氯水或KMnO4作氧化剂,则过量的这些氧化剂在滴定时会氧化硫代硫酸钠而导致测定结果偏大。(2分)
(4)0.06410% (3分)
16.(8分)
----化学.files/image034.gif) (1)
(1分) CO(NH2)2 (1分)
(1)
(1分) CO(NH2)2 (1分)
(2) N2+Al2O3+----化学.files/image035.gif)
----化学.files/image036.gif) 3CO+2AlN (2分)
3CO+2AlN (2分)
(3) AlN+OH-+H2O =AlO----化学.files/image038.gif) +NH3↑ (2分)
+NH3↑ (2分)
(4) ④⑦ (2分)
17.(8分)
(1)温度较低(2分)
(2)AC(2分)
(3)2Fe3+ + 3ClO- + 10 OH- = 2FeO4-+ 3Cl-+ 5H2O (2分)
(4)B、D(2分)
18.(10分)
(1)CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g)
△H=一867 kJ?mol一1 (2分)
(2) Na2S+2H2O----化学.files/image040.gif) S↓+H2↑+2NaOH (2分) 或S2-+2H2O
S↓+H2↑+2NaOH (2分) 或S2-+2H2O----化学.files/image040.gif) S↓+H2↑+2OH-
S↓+H2↑+2OH-
(3)Ksp(HgS)<Ksp(FeS) (2分) 因发生Hg2++FeS=HgS+Fe2+,产生的Fe2+可被氧化为Fe3+,Fe3+水解形成Fe(OH)3胶体,吸附悬浮杂质而净化水(2分)
(4)尿素法成本低,节约能源。(2分)
----化学.files/image041.gif) 19.(12分)
19.(12分)
(1) (2分)
(2) 3种 (2分)
(3) 6 (2分)
(4)A: ----化学.files/image043.jpg) (2分)
② 过氧化物、HBr(1分)
(2分)
② 过氧化物、HBr(1分)
----化学.files/image045.jpg) |
B: (2分) ④ 浓硫酸(1分)
20.(10分)
(1)不能 (1分) BaCO3会与胃酸反应产生Ba2+使人中毒 (2分) 或说由于存在溶解平衡:BaCO3(s) ----化学.files/image047.gif) Ba2+(aq)+CO32-(aq),服下BaCO3后,胃酸可与CO32-反应生成CO2和水,CO32-浓度降低,BaCO3的沉淀溶解平衡向右移动,Ba2+浓度增大引起人体中毒。
Ba2+(aq)+CO32-(aq),服下BaCO3后,胃酸可与CO32-反应生成CO2和水,CO32-浓度降低,BaCO3的沉淀溶解平衡向右移动,Ba2+浓度增大引起人体中毒。
(2)BaSO4(s)----化学.files/image048.gif) Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
C(Ba2+)=1.1×10-10/0.36 =3.1×10-10 < 2×10-3mol?L-1
可以有效除去Ba2+ (3分)
(3)Ba2+ ~ BaCrO4 ~----化学.files/image050.gif) Cr2O72-~
Cr2O72-~----化学.files/image052.gif) I2~ 3S2O32-
I2~ 3S2O32-
1mol 3mol
36.00×0.100×10-3mol
c(Ba2+)----化学.files/image054.gif) mol?L-1
(4分)
mol?L-1
(4分)
四、选做题(本题包括1小题,共12分)
21.(12分)
(1)1s22s22p63s23p63d104s24p1 (2分)
(2)ACD (2分)
(3)非极性分子(2分) 三角锥 (2分) sp2 (2分)
(4)NH3分子间能形成氢键,而AsH3分子间不能形成氢键 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com