
题目列表(包括答案和解析)
| A、pH=2的盐酸与pH=12的KOH溶液,水电离的c(H+)浓度相等 | B、分别将pH=2的盐酸和醋酸溶液稀释到pH=4,后者加入水的体积大 | C、在含有AgBr沉淀的悬浊液中加入少量NaBr固体,c(Br-)增大 | D、同浓度、同体积的强酸与强碱溶液混合后,溶液的pH一定等于7 |
| A、同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | B、pH=a的强酸与pH=b的碱等体积混合后,溶液的pH=7 | C、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 | D、在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
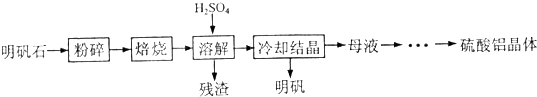
| 物质 | α-Al2O3 | γ-Al2O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α-Al2O3 |
| 温度/℃ 溶解度/g |
0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com